新藥FDA注冊審批過程(CDER)
開發新藥
美國消費者受益于獲得世界上最安全和最先進的藥品系統。該系統中的主要消費者監督機構是FDA的藥物評估和研究中心(CDER)。
該中心最著名的工作是在新藥上市前對其進行評估。CDER的評估不僅防止了庸醫,而且還為醫生和病人提供了他們明智地使用藥物所需的信息。該中心確保藥品,無論是品牌藥品還是非專利藥品,都能正常工作,而且其健康益處大于已知的風險。
尋求在美國銷售一種藥物的制藥公司必須首先對其進行測試。然后,該公司向CDER發送這些測試的證據,以證明該藥物對其預期用途是安全和有效的。一個由CDER醫生、統計學家、化學家、藥劑師和其他科學家組成的團隊對公司的數據進行了審查,并提出了標簽的建議。如果這一獨立和公正的審查確定,一種藥物的健康利益大于其已知的風險,該藥物被批準出售。該中心實際上并不測試藥物本身,盡管它在藥品質量、安全性和有效性標準方面進行了有限的研究。
在藥物能夠在人體內進行測試之前,制藥公司或贊助者會進行實驗室和動物測試,以了解藥物是如何起作用的,以及藥物在人體中是否安全有效。接下來,我們開始對人們進行一系列測試,以確定這種藥物在治療疾病時是否安全,以及它是否提供了真正的健康益處。
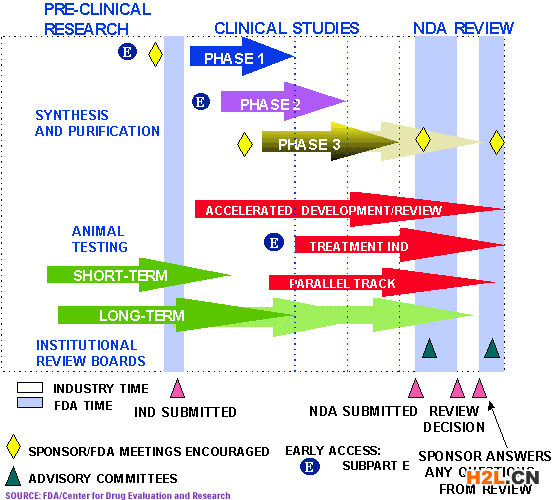
FDA批準:這意味著什么?
FDA對一種藥物的批準意味著CDER已經審查了關于該藥物效果的數據,并且該藥物被確定能提供超過其已知和潛在風險對預期人群的益處。藥物批準程序是在一個結構化的框架內進行的,其中包括:
1.目標條件及有效治療方法分析-FDA審查員分析該藥的病情或疾病,并評估目前的治療情況,這為權衡藥物的風險和益處提供了背景。例如,一種用于治療沒有其他治療方法的危及生命的疾病患者的藥物,即使這些風險在沒有生命威脅的情況下被認為是不可接受的,也可能被認為具有超過風險的益處。
2.從臨床數據中評估效益和風險-FDA審查員評估藥物制造商提交的臨床效益和風險信息,同時考慮到數據不完善或不完整可能導致的任何不確定性。一般來說,該機構預計制藥商將提交兩項精心設計的臨床試驗的結果,以確保第一次試驗的結果不是偶然或偏見的結果。
在某些情況下,特別是如果這種疾病很少見,而且多項試驗可能不可行,一項臨床試驗的令人信服的證據可能就足夠了。證明這種藥物會使目標人群受益的證據應該超過任何風險和不確定性。
3.風險管理戰略-所有毒品都有風險,風險管理策略包括FDA批準的藥品標簽,該標簽清楚地描述了藥物的好處和風險,以及如何檢測和管理風險。有時,需要更多的努力來管理風險。在這種情況下,制藥商可能需要實施風險管理和緩解戰略(REMS)。
盡管許多FDA的風險效益評估和決策都是直截了當的,但有時利益和風險是不確定的,可能難以解釋或預測。FDA和藥品制造商在分析相同的數據后可能得出不同的結論,或者FDA審查小組的成員之間可能存在意見分歧。作為一個以科學為主導的組織,FDA利用現有的最佳科學和技術信息,通過審議過程作出決定。
加速FDA批準:
在某些情況下,新藥的批準會加快,加速批準可用于治療嚴重或危及生命的有希望的療法,并提供比現有療法更好的治療效果。這一方法允許批準一種藥物,該藥物顯示對合理可能預測臨床效益的“代孕終點”有影響,或對較早發生的臨床終點有影響,但可能不像批準的標準終點那么可靠。
當藥物用于治療病程較長的疾病,并且需要較長的時間來衡量其療效時,這種批準途徑尤其有用。藥品進入市場后,制藥商必須進行市場營銷后的臨床試驗,以驗證和描述藥物的效益。如果進一步的試驗無法驗證預期的臨床效益,FDA可能會撤銷批準。
自1992年加速批準途徑建立以來,許多治療生命危險疾病的藥物被成功地推向市場,并對疾病的病程產生了重大影響。例如,許多用于治療艾滋病毒/艾滋病的抗逆轉錄病毒藥物通過加速批準進入市場,隨后改變了治療模式。一些有針對性的抗癌藥物也通過這一途徑進入市場。
藥物開發名稱
該機構還采用了幾種方法來鼓勵某些藥物的開發,特別是那些可能是第一種治療疾病的藥物,或者那些對現有藥物有很大好處的藥物。這些方法或名稱是為了滿足具體需要,如果適用的話,一個新的藥物應用程序可以得到一個以上的指定。每一種指定都有助于確保一旦審查員得出結論認為他們的益處證明他們的風險是合理的,就會立即向病人提供治療嚴重疾病的療法。
快軌這是一個過程,旨在促進開發和推進對治療嚴重疾病的藥物的審查,并根據有希望的動物或人類數據滿足未滿足的醫療需求。快速追蹤可以更早地給病人提供重要的新藥。制藥公司必須要求快車道程序。
突破療法指定加速開發和審查旨在治療嚴重疾病的藥物,初步的臨床證據表明,該藥物可能比現有療法有很大的改善。一種具有突破療法的藥物也有資格進入快車道過程。藥品公司必須申請突破療法的稱號。
優先審查這意味著FDA的目標是在6個月內對申請采取行動,而不是在標準審查下的10個月內采取行動。優先審查指定將指導注意力和資源,以評估藥物,將大大改善治療,診斷,或預防的嚴重情況。
中企檢測認證網提供iso體系認證機構查詢,檢驗檢測、認證認可、資質資格、計量校準、知識產權貫標一站式行業企業服務平臺。中企檢測認證網為檢測行業相關檢驗、檢測、認證、計量、校準機構,儀器設備、耗材、配件、試劑、標準品供應商,法規咨詢、標準服務、實驗室軟件提供商提供包括品牌宣傳、產品展示、技術交流、新品推薦等全方位推廣服務。這個問題就給大家解答到這里了,如還需要了解更多專業性問題可以撥打中企檢測認證網在線客服13550333441。為您提供全面檢測、認證、商標、專利、知識產權、版權法律法規知識資訊,包括商標注冊、食品檢測、第三方檢測機構、網絡信息技術檢測、環境檢測、管理體系認證、服務體系認證、產品認證、版權登記、專利申請、知識產權、檢測法、認證標準等信息,中企檢測認證網為檢測認證商標專利從業者提供多種檢測、認證、知識產權、版權、商標、專利的轉讓代理查詢法律法規,咨詢輔導等知識。
本文內容整合網站:百度百科、搜狗百科、360百科、知乎、市場監督總局 、國家認證認可監督管理委員會、質量認證中心
免責聲明:本文部分內容根據網絡信息整理,文章版權歸原作者所有。向原作者致敬!發布旨在積善利他,如涉及作品內容、版權和其它問題,請跟我們聯系刪除并致歉!






