FDA認證將I類設備UDI截止日期推遲到2023年9月
FDA將I類設備的UDI
2023年6月30日,FDA認證頒布了有關其政策的即時生效指南,該政策涉及I類和不可植入,無法維持生命或無法維持生命的未分類設備的合規日期。該指南解釋說,目前,FDA并不打算強制執行UDI標簽(21 CFR 801.20&801.50),直接標記(21 CFR 801.45),GUDID數據提交(21 CFR 830.300)和標準日期格式(21 CFR)。 801.18)要求在2023年9月24日之前。
FDA建立了獨特的設備識別系統,以充分識別從制造到分銷再到患者使用在美國銷售的醫療設備。
全面實施后,大多數設備的標簽都將包含人類和機器可讀形式的唯一設備標識符(UDI),這將最終提高患者安全性,使設備售后監視現代化并促進醫療設備創新。
該決定部分是由于冠狀病毒的持續流行所致。FDA在其指南中表示:“準備實施UDI要求,同時應對與2023年冠狀病毒病相關的挑戰可能非常困難,并且可能會將資源從COVID-19應對工作中轉移出來。” “在一定程度上,該政策可以幫助貼標商繼續關注與COVID-19相關的公共衛生需求,我們認為該政策與公共衛生更加一致。”
盡管存在延遲,但還是要謹慎準備,盡早開始,因為許多UDI標簽制造商都面臨實施方面的挑戰。為了幫助行業做好準備,我們匯總了自2014年發布UDI規則以來發布的資源。
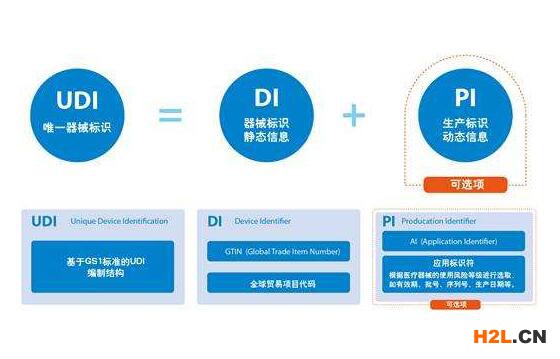
什么是UDI?
UDI是數字或字母數字代碼,由兩部分組成:設備標識符(DI)和生產標識符(PI)。對于所有UDI,DI是固定的和強制性的。它標識標簽和設備的特定版本或型號。PI是UDI的有條件的可變部分,用于標識標簽中包含的以下一項或多項內容:
批號或批號
序列號
到期日
制造日期
被調節為設備的人體細胞,組織或基于細胞和組織的產品(HCT / P)的獨特識別碼
相關產品FDA認證可咨詢快速辦理!
中企檢測認證網提供iso體系認證機構查詢,檢驗檢測、認證認可、資質資格、計量校準、知識產權貫標一站式行業企業服務平臺。中企檢測認證網為檢測行業相關檢驗、檢測、認證、計量、校準機構,儀器設備、耗材、配件、試劑、標準品供應商,法規咨詢、標準服務、實驗室軟件提供商提供包括品牌宣傳、產品展示、技術交流、新品推薦等全方位推廣服務。這個問題就給大家解答到這里了,如還需要了解更多專業性問題可以撥打中企檢測認證網在線客服13550333441。為您提供全面檢測、認證、商標、專利、知識產權、版權法律法規知識資訊,包括商標注冊、食品檢測、第三方檢測機構、網絡信息技術檢測、環境檢測、管理體系認證、服務體系認證、產品認證、版權登記、專利申請、知識產權、檢測法、認證標準等信息,中企檢測認證網為檢測認證商標專利從業者提供多種檢測、認證、知識產權、版權、商標、專利的轉讓代理查詢法律法規,咨詢輔導等知識。
本文內容整合網站:百度百科、搜狗百科、360百科、知乎、市場監督總局 、國家認證認可監督管理委員會、質量認證中心
免責聲明:本文部分內容根據網絡信息整理,文章版權歸原作者所有。向原作者致敬!發布旨在積善利他,如涉及作品內容、版權和其它問題,請跟我們聯系刪除并致歉!