FDA認證QSIT:了解醫療器械QMS檢查期間會發生什么
與大多數其他國家/地區的監管機構不同,美國食品藥品監督管理局(FDA認證)依靠隨機檢查來保持醫療器械制造商的誠實。
隨時可能進行隨機審核,這意味著制造商必須始終遵守FDA認證質量體系法規(QSR)。
每年都有太多的醫療器械制造商需要FDA認證進行檢查,因此FDA認證根據制造商及其設備帶來的風險來優先安排有限的檢查人員。一些公司比其他公司更受關注。通常,II級和III級制造商可以期望每兩年進行一次FDA認證訪問。基于風險的方法意味著擁有新的或現有的III類設備的公司是最高優先級,尤其是那些制造可植入并具有生命支持設備的公司。與最近通過510(k)流程推出設備的任何公司一樣,第二類制造商(占批量的大部分)也緊隨其后。有時,FDA認證將檢查風險較高的I類制造商。
FDA認證檢查的提前通知以及接下來發生的事情
通常,FDA認證將在檢查前至少5天通知美國制造商。外國公司通常會提前得到通知,以便安排旅行和翻譯。在檢查之前,FDA認證可能會要求您將質量體系手冊和管理審查程序的副本發送給他們,以促進檢查。您無需發送這些文件,但是如果拒絕發送,則可能會使檢查人員陷入困境,以為您有隱藏的東西。
當FDA認證檢查員到達時(根據公司的規模,可能會有不止一個),他們將出示證章并要求與最高管理人員會面。雖然可以寫下他們的姓名和徽章編號,但您不得拍照或復制他們的徽章。然后,他們將提交482表“檢查通知 ”作為正式手續,并舉行一次開幕會議,以了解有關您公司和產品的結構的更多信息,然后進行一次工廠參觀。
FDA認證 QSIT方法論解釋了
QSIT代表質量體系檢查技術,它描述了FDA認證處理質量管理體系(QMS)的方式。這種方法著重于檢查過程,然后檢查與它們相關的記錄。要了解其內容和方法,請研究108頁的QSIT手冊,該手冊旨在指導FDA認證現場人員并與可能參與檢查的其他人員共享。它的日期為1999年,但今天仍在使用。
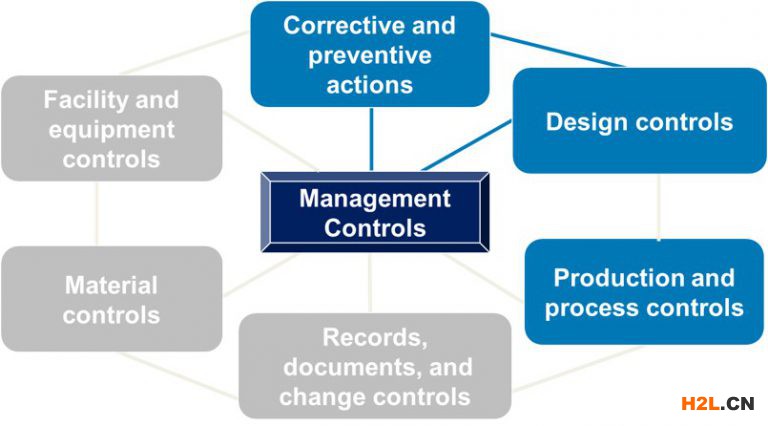
QSIT流程著重于四個主要子系統(如下藍色所示),最終的問題是:管理團隊是否提供了必要的資源來建立和維護有效的QMS?通過與四個主要子系統的鏈接來檢查其他三個子系統。所有七個子系統都圍繞管理控件運行。
FDA認證 QSIT檢查的三個級別
如果這是您首次進行FDA認證審核,則檢查員將涵蓋所有四個子系統。在隨后的常規檢查中,檢查員將覆蓋CAPA以及一個附加子系統。正如FDA認證在2023年指導文件草案中所解釋的那樣,典型檢查預計將持續3-6個工作日。FDA認證應在通知您即將進行的審核時告訴您檢查將持續多長時間。

FDA認證檢驗員在QSIT審核中正在尋找什么
它從對您的程序進行審查開始,然后深入到相關記錄的隨機抽樣中。(如果您喜歡統計數據,并且想了解FDA認證將審查的樣品數量,您將享受 QSIT手冊的第103-107頁。)FDA認證檢查員將不會審查您的內部審核報告,供應商審核報告或您的管理人員審查會議記錄,除非他們提出書面要求。但是,他們將檢查以確保您具有這些文件。
如下表所示,雖然檢查是有條不紊的,但檢查員如果發現需要關注的地方,可能會做得更深入。在進行檢查時,他們會指出483表實時觀察。這些問題比“討論項目”更令人關注,后者已記錄在最終報告中,但以后可以提升為觀察結果。您可以期望FDA認證檢查員每天與管理團隊舉行會議,以披露當天發現的信息。




FDA認證 QSIT檢查結論會發生什么?
在對您來說肯定是一個辛苦而又壓力大的一周的結論之后,研究人員將與管理層見面,以復審所有觀察和討論要點。檢查人員將為管理層提供捍衛或澄清其職位的機會,并將一切內容記錄在企業檢查報告(EIR)中。您的檢查日期和狀態(而不是實際的EIR)將在一周內在FDA認證網站(此處)上發布。這里最重要的字段是“分類”,分為三類:
NAI-未指示任何操作(檢查進行得很好,這是您想要看到的內容)
VAI –指示采取自愿行動(檢查人員發現了一些問題; FDA認證希望該公司采取糾正措施)
OAI-已指示官方行動(檢查人員發現了嚴重問題;這意味著可能會發出483)
當然,結果并不會讓您感到驚訝,因為FDA認證的檢查員會在整個檢查和日常會議中指出問題。這是有關FDA認證如何發布結論和決定的更多信息。您可以在60天內索取一份EIR副本。如果事情進展不順利,檢查人員可能會簽發FDA認證 483表格,您將有15天的時間做出回應。FDA認證可以通過發布警告信使事情更上一層樓,但這越來越罕見。
提供美國FDA認證服務!
中企檢測認證網提供iso體系認證機構查詢,檢驗檢測、認證認可、資質資格、計量校準、知識產權貫標一站式行業企業服務平臺。中企檢測認證網為檢測行業相關檢驗、檢測、認證、計量、校準機構,儀器設備、耗材、配件、試劑、標準品供應商,法規咨詢、標準服務、實驗室軟件提供商提供包括品牌宣傳、產品展示、技術交流、新品推薦等全方位推廣服務。這個問題就給大家解答到這里了,如還需要了解更多專業性問題可以撥打中企檢測認證網在線客服13550333441。為您提供全面檢測、認證、商標、專利、知識產權、版權法律法規知識資訊,包括商標注冊、食品檢測、第三方檢測機構、網絡信息技術檢測、環境檢測、管理體系認證、服務體系認證、產品認證、版權登記、專利申請、知識產權、檢測法、認證標準等信息,中企檢測認證網為檢測認證商標專利從業者提供多種檢測、認證、知識產權、版權、商標、專利的轉讓代理查詢法律法規,咨詢輔導等知識。
本文內容整合網站:百度百科、搜狗百科、360百科、知乎、市場監督總局 、國家認證認可監督管理委員會、質量認證中心
免責聲明:本文部分內容根據網絡信息整理,文章版權歸原作者所有。向原作者致敬!發布旨在積善利他,如涉及作品內容、版權和其它問題,請跟我們聯系刪除并致歉!