什么是FDA注冊(cè)?
FDA在美國(guó)乃至世界上都有深入的影響,有“美國(guó)人健康守護(hù)神”之稱。申報(bào)的產(chǎn)品需求經(jīng)過(guò)對(duì)人體運(yùn)用產(chǎn)品后143個(gè)要害檢測(cè)點(diǎn)位作監(jiān)測(cè),對(duì)2-3萬(wàn)人繼續(xù)3-7年的監(jiān)測(cè),全部都合格經(jīng)過(guò)的產(chǎn)品,才予以核發(fā)FDA認(rèn)證。因此FDA認(rèn)證被世界衛(wèi)生組織認(rèn)定為最高食物安全規(guī)范,很多國(guó)際廠商都以追求獲得 FDA 認(rèn)證作為產(chǎn)品品質(zhì)的最高榮譽(yù)和保證。

FDA世界自在出售許可證不只是美國(guó)FDA認(rèn)證中最高檔別的認(rèn)證,并且是世貿(mào)組織(WTO)核定有關(guān)食物、藥品的最高通行認(rèn)證,是唯一有必要經(jīng)過(guò)美國(guó)FDA和世界貿(mào)易組織全面核定后才可發(fā)放的認(rèn)證證書。一旦獲此認(rèn)證,產(chǎn)品暢通進(jìn)入任何WTO成員國(guó)家,甚至連行銷形式,所在國(guó)政府都不得干涉。
在市場(chǎng)經(jīng)濟(jì)全球化的大環(huán)境下,伴隨著中國(guó)產(chǎn)品的國(guó)際化戰(zhàn)略的正式實(shí)施,越來(lái)越多的中國(guó)企業(yè)已經(jīng)開(kāi)始瞄準(zhǔn)美國(guó)FDA認(rèn)證,為的是打開(kāi)美國(guó)市場(chǎng)甚至全球市場(chǎng)的大門,最終把產(chǎn)品銷售到歐洲和美國(guó)龐大市場(chǎng)中去。應(yīng)該明確指出的一點(diǎn)是,美國(guó)FDA認(rèn)證對(duì)中國(guó)制造業(yè)的意義絕不是僅僅是這樣而已。業(yè)內(nèi)專家指出,目前中國(guó)的食品和產(chǎn)品安全問(wèn)題受到全國(guó)人民乃至全球各國(guó)人士的廣泛關(guān)注,而毋庸置疑的是FDA認(rèn)證被確認(rèn)為世界上最高的產(chǎn)品安全標(biāo)準(zhǔn),如果中國(guó)的產(chǎn)品通過(guò)美國(guó)FDA認(rèn)證,將有效地提高企業(yè)的聲譽(yù)和樹(shù)立品牌形象,然后促進(jìn)中國(guó)的產(chǎn)品達(dá)到國(guó)際標(biāo)準(zhǔn),最終促進(jìn)制造業(yè)的發(fā)展。
此外中國(guó)產(chǎn)品通過(guò)FDA認(rèn)證,相當(dāng)?shù)玫搅诉M(jìn)入美國(guó)市場(chǎng)的通行證。據(jù)報(bào)道,美國(guó)是一個(gè)商品進(jìn)口大國(guó),美國(guó)國(guó)內(nèi)很大一部分的產(chǎn)品都依賴進(jìn)口。以藥品為例,美國(guó)百分之八十用于制劑的原料來(lái)自海外市場(chǎng),占世界藥品市場(chǎng)的三分之一。根據(jù)整體的藥物使用情況來(lái)看,醫(yī)學(xué)信息研究所報(bào)道二零一一年美國(guó)產(chǎn)品總支出增加百分之三點(diǎn)七,合計(jì)三千二百億美元,而在二零一一年,過(guò)去兩年的品牌藥物成本為一百二十二億美金而在去年同期為八十五億美金。其中,仿制藥的費(fèi)用占處方藥支出的百分之八十,增加了五億美元。就中國(guó)而言,美國(guó)產(chǎn)品市場(chǎng)的發(fā)展?jié)摿O大地吸引了中國(guó)有能力進(jìn)入國(guó)際市場(chǎng)的公司企業(yè)。因此中國(guó)產(chǎn)品通過(guò)美國(guó)FDA認(rèn)證真的是好處多多。
食品藥品監(jiān)督管理局負(fù)責(zé)通過(guò)確保人類和獸藥,生物制品和醫(yī)療器械的安全性,有效性和安全性來(lái)保護(hù)公眾健康;并確保我們國(guó)家的食品供應(yīng),化妝品和輻射產(chǎn)品的安全。
FDA還負(fù)責(zé)監(jiān)管煙草制品的生產(chǎn),營(yíng)銷和分銷,以保護(hù)公眾健康并減少未成年人的煙草使用。
FDA負(fù)責(zé)推動(dòng)公共衛(wèi)生,推動(dòng)創(chuàng)新,使醫(yī)療產(chǎn)品更有效,更安全,更實(shí)惠,并幫助公眾獲得使用醫(yī)療產(chǎn)品和食品維持及改善所需的準(zhǔn)確,科學(xué)信息他們的健康。
FDA還在國(guó)家的反恐能力中發(fā)揮了重要作用。FDA通過(guò)確保食品供應(yīng)的安全性和促進(jìn)醫(yī)療產(chǎn)品的開(kāi)發(fā)來(lái)應(yīng)對(duì)這一責(zé)任,以應(yīng)對(duì)蓄意和自然出現(xiàn)的公共衛(wèi)生威脅。
1.1 FDA工廠注冊(cè)簡(jiǎn)介
FDA工廠注冊(cè),即“Establishment Registration”,又叫場(chǎng)地注冊(cè)。產(chǎn)品登記,即“Listing”。
根據(jù)美國(guó)聯(lián)邦食品藥品化妝品管理法和美國(guó)聯(lián)邦法規(guī)相關(guān)要求,任何從事藥品生產(chǎn)和包裝活動(dòng)的企業(yè)必須將其生產(chǎn)地址與產(chǎn)品在FDA登記。此項(xiàng)要求對(duì)美國(guó)本土企業(yè)和海外企業(yè)同樣適用。
對(duì)于海外企業(yè),工廠注冊(cè)和產(chǎn)品登記是美國(guó)FDA對(duì)進(jìn)口藥品的重要監(jiān)管措施之一。FDA可以通過(guò)注冊(cè)號(hào)第一時(shí)間查到相關(guān)企業(yè)的詳細(xì)信息,并可及時(shí)聯(lián)系相關(guān)企業(yè)在美國(guó)的代理人,有效掌握相關(guān)企業(yè)產(chǎn)品在美信息。
自2009年6月1日起,F(xiàn)DA不再接受紙質(zhì)的工廠注冊(cè)和產(chǎn)品登記,而一律采用電子方式進(jìn)行注冊(cè)登記。
1.2 FDA工廠自認(rèn)定簡(jiǎn)介
FDA工廠自認(rèn)定,即“Facility Self-identification”,是根據(jù)FDA在2012年10月頒布執(zhí)行的仿制藥用戶收費(fèi)修正案(Generic Drug User Fee Amendments of 2012.簡(jiǎn)稱GDUFA)中的相關(guān)要求,對(duì)仿制藥藥品生產(chǎn)企業(yè)執(zhí)行的一項(xiàng)工廠備案及收費(fèi)項(xiàng)目。
GDUFA旨在加快仿制藥的審批程序,更高效的為用戶提供安全有效的仿制藥。GDUFA要求由藥廠承擔(dān)在仿制藥審評(píng)和現(xiàn)場(chǎng)檢查所發(fā)生的費(fèi)用。這些費(fèi)用將有助于FDA減少申請(qǐng)審評(píng)時(shí)間和申請(qǐng)審評(píng)滯后的問(wèn)題,降低藥品審評(píng)的平均周期,增加基于風(fēng)險(xiǎn)評(píng)估的現(xiàn)場(chǎng)審計(jì)。
FDA工廠自認(rèn)定需要遞交工廠的基本信息,如工廠名稱、地址、聯(lián)系方式、聯(lián)系人信息、FEI登記號(hào)、D-U-N-S號(hào)等。這些信息需要用FDA指定的SPL表格填寫完成,再通過(guò)FDA電子通路完成遞交。完成遞交后,系統(tǒng)自動(dòng)驗(yàn)證表格的準(zhǔn)確性,并由FDA更新至GDUFA數(shù)據(jù)庫(kù)。
FDA工廠自認(rèn)定需要繳納場(chǎng)地費(fèi)(Facility Fee),如不能及時(shí)繳納,將會(huì)引起一系列后果。
1.3 NDC申請(qǐng)簡(jiǎn)介
NDC,是“National Drug Code”的簡(jiǎn)稱,譯為“國(guó)家藥品代碼”,是藥品作為普通商品的識(shí)別符號(hào)。NDC數(shù)據(jù)庫(kù)可公開(kāi)查詢,它包括了所有的處方藥和非處方藥,但不包括獸藥、血液制品和非最終上市的藥品,如原料藥(API)。
任何藥品在美國(guó)上市前必須申請(qǐng)并登記NDC號(hào),登記的主要信息包括藥品名稱、生產(chǎn)商、藥品分類、給藥途徑、上市日期、OTC專論號(hào)和標(biāo)簽等信息。具有NDC號(hào)的藥品在符合FDA相關(guān)藥品管理法的基礎(chǔ)上可在美國(guó)上市,銷售商和終端用戶可以根據(jù)此號(hào)碼查詢到產(chǎn)品的有關(guān)功效和特點(diǎn),同時(shí)FDA也根據(jù)此號(hào)碼對(duì)產(chǎn)品進(jìn)行管理。
獲得了NDC號(hào),僅代表藥品信息進(jìn)入了FDA登記系統(tǒng),但是,在NDC數(shù)據(jù)庫(kù)登記的產(chǎn)品并不意味著該藥品被FDA批準(zhǔn)或可作為藥物銷售,也不意味著這個(gè)產(chǎn)品可以享受醫(yī)療報(bào)銷或由其他組織承擔(dān)費(fèi)用。
但是,NDC登記是中國(guó)非處方藥通過(guò)FDA認(rèn)證的快捷申請(qǐng)形式。對(duì)于收載于OTC專論中的藥品,在美國(guó)上市前無(wú)需審批,僅需按照相關(guān)要求提供進(jìn)行NDC登記的必要信息。通過(guò)NDC登記的中藥和非處方藥可在中西藥房銷售。因此,NDC登記是中藥及非處方藥進(jìn)入美國(guó)的一條很好的途徑。
二. 服務(wù)內(nèi)容
根據(jù)美國(guó)FDA關(guān)于電子注冊(cè)與電子提交的最新要求,康利華咨詢提供有關(guān)FDA電子注冊(cè)與電子提交的全套服務(wù)。
服務(wù)內(nèi)容包括:代理DUNS號(hào)申請(qǐng);代理工廠識(shí)別號(hào)(FEI, Facility Establishment Identifier)申請(qǐng)、代理NDC登記與維護(hù),代理DMF文件e-CTD遞交與維護(hù)等。
三. 項(xiàng)目流程
通用流程如下:
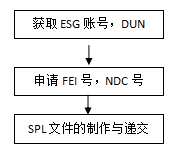
ESG:全稱為“Electronic Submission Gateway”,是進(jìn)行電子遞交的通路;
DUNS號(hào):即D-U-N-S碼,也叫“鄧白氏碼”、“鄧氏全球編碼”,是一個(gè)獨(dú)一無(wú)二的9位數(shù)字編碼,為全球企業(yè)用以識(shí)別、組織及鏈接全球企業(yè)家族機(jī)構(gòu)的標(biāo)準(zhǔn);
FEI號(hào):全稱為“Facility Establishment Identifier”,通常譯為“工廠識(shí)別號(hào)”,是FDA用來(lái)識(shí)別企業(yè)的獨(dú)有號(hào)碼;
SPL:全稱為“Structured Product Labeling”,是FDA在工廠注冊(cè)及藥品登記時(shí)所應(yīng)用的標(biāo)準(zhǔn)。
中企檢測(cè)認(rèn)證網(wǎng)提供iso體系認(rèn)證機(jī)構(gòu)查詢,檢驗(yàn)檢測(cè)、認(rèn)證認(rèn)可、資質(zhì)資格、計(jì)量校準(zhǔn)、知識(shí)產(chǎn)權(quán)貫標(biāo)一站式行業(yè)企業(yè)服務(wù)平臺(tái)。中企檢測(cè)認(rèn)證網(wǎng)為檢測(cè)行業(yè)相關(guān)檢驗(yàn)、檢測(cè)、認(rèn)證、計(jì)量、校準(zhǔn)機(jī)構(gòu),儀器設(shè)備、耗材、配件、試劑、標(biāo)準(zhǔn)品供應(yīng)商,法規(guī)咨詢、標(biāo)準(zhǔn)服務(wù)、實(shí)驗(yàn)室軟件提供商提供包括品牌宣傳、產(chǎn)品展示、技術(shù)交流、新品推薦等全方位推廣服務(wù)。這個(gè)問(wèn)題就給大家解答到這里了,如還需要了解更多專業(yè)性問(wèn)題可以撥打中企檢測(cè)認(rèn)證網(wǎng)在線客服13550333441。為您提供全面檢測(cè)、認(rèn)證、商標(biāo)、專利、知識(shí)產(chǎn)權(quán)、版權(quán)法律法規(guī)知識(shí)資訊,包括商標(biāo)注冊(cè)、食品檢測(cè)、第三方檢測(cè)機(jī)構(gòu)、網(wǎng)絡(luò)信息技術(shù)檢測(cè)、環(huán)境檢測(cè)、管理體系認(rèn)證、服務(wù)體系認(rèn)證、產(chǎn)品認(rèn)證、版權(quán)登記、專利申請(qǐng)、知識(shí)產(chǎn)權(quán)、檢測(cè)法、認(rèn)證標(biāo)準(zhǔn)等信息,中企檢測(cè)認(rèn)證網(wǎng)為檢測(cè)認(rèn)證商標(biāo)專利從業(yè)者提供多種檢測(cè)、認(rèn)證、知識(shí)產(chǎn)權(quán)、版權(quán)、商標(biāo)、專利的轉(zhuǎn)讓代理查詢法律法規(guī),咨詢輔導(dǎo)等知識(shí)。
本文內(nèi)容整合網(wǎng)站:百度百科、搜狗百科、360百科、知乎、市場(chǎng)監(jiān)督總局 、國(guó)家認(rèn)證認(rèn)可監(jiān)督管理委員會(huì)、質(zhì)量認(rèn)證中心
免責(zé)聲明:本文部分內(nèi)容根據(jù)網(wǎng)絡(luò)信息整理,文章版權(quán)歸原作者所有。向原作者致敬!發(fā)布旨在積善利他,如涉及作品內(nèi)容、版權(quán)和其它問(wèn)題,請(qǐng)跟我們聯(lián)系刪除并致歉!
本文來(lái)源: http://www.rumin8raps.com/zs/202303/ccaa_47188.html






