原標(biāo)題:藥品專利鏈接制度解讀 | 品一品原研藥企和仿制藥企這碗水是如何被“端平”的
創(chuàng)新藥物的研發(fā)具有高投入、高風(fēng)險(xiǎn)的特點(diǎn)。根據(jù)羅氏集團(tuán)公布的數(shù)據(jù)顯示,一個(gè)創(chuàng)新藥物的研發(fā)要經(jīng)過(guò)7000874小時(shí)的工作,6587次實(shí)驗(yàn),423項(xiàng)研究,這些數(shù)據(jù)的完成大約需要12年的時(shí)間,以獲得最終的研發(fā)藥物。誠(chéng)然,賦予創(chuàng)新藥一定時(shí)期的壟斷性權(quán)利是有效且唯一的激勵(lì)機(jī)制。然而,藥品因關(guān)乎人類的生命及身體健康而屬于一類特殊的商品,如果給予原研藥過(guò)長(zhǎng)的技術(shù)壟斷期限,將會(huì)嚴(yán)重影響社會(huì)公眾對(duì)藥品的可獲得性。此時(shí),藥品專利鏈接制度承載著平衡原研藥企與仿制藥企之間利益沖突的使命而誕生。
一、 我國(guó)為什么需要專利鏈接制度?
所謂專利鏈接,是指仿制藥上市審批與原研藥品專利期滿相“鏈接”,即仿制藥注冊(cè)申請(qǐng)應(yīng)當(dāng)考慮先前已上市藥品的專利狀況,從而避免可能的專利侵權(quán)。這一制度源于美國(guó)1984年通過(guò)的《藥品價(jià)格競(jìng)爭(zhēng)和專利期補(bǔ)償法》(Hatch-Waxman Act)。
專利鏈接制度建立以前,國(guó)家藥品監(jiān)督管理局(以下簡(jiǎn)稱“國(guó)家藥監(jiān)局”)在審批仿制藥的注冊(cè)申請(qǐng)時(shí),往往不考慮藥品專利權(quán)狀況,僅對(duì)仿制藥的安全性及有效性進(jìn)行審核后即作出是否準(zhǔn)予上市的決定。這樣的審批程序,不僅會(huì)導(dǎo)致仿制藥在原研藥專利有效期內(nèi)即可獲批上市的尷尬局面,也將必然引發(fā)專利侵權(quán)糾紛。
對(duì)于大部分原研藥企來(lái)說(shuō),專利保護(hù)期屆滿前的最后幾年甚至幾個(gè)月才是獲得利益回報(bào)的關(guān)鍵節(jié)點(diǎn),而幾乎所有原研藥企都難逃“專利懸崖”[1]的厄運(yùn)。這種情況下,如果仿制藥能夠以更低廉的成本獲得上市銷售,并在原研藥企本該享有壟斷地位的市場(chǎng)中分得一杯羹,將會(huì)對(duì)原研藥企構(gòu)成極大的威脅。相反,對(duì)仿制藥企來(lái)說(shuō),盡管獲得了“強(qiáng)仿上市”,但其也時(shí)刻面臨著被專利權(quán)人提起侵權(quán)訴訟以及司法禁令的風(fēng)險(xiǎn)。從這一角度來(lái)說(shuō),專利鏈接制度是原研藥企與仿制藥企共同的需求。
的確,我國(guó)藥品市場(chǎng)發(fā)展的初期,中國(guó)主要以仿制藥為主,相應(yīng)的政策也能夠清楚地反映出對(duì)仿制藥企業(yè)的“偏愛(ài)”。而隨著中國(guó)藥企的經(jīng)營(yíng)模式由“以仿為主”逐步轉(zhuǎn)為“仿創(chuàng)結(jié)合”,我國(guó)以美國(guó)《藥品價(jià)格競(jìng)爭(zhēng)和專利期補(bǔ)償法》為范本,探索建立了“Bolar例外”原則、藥品試驗(yàn)數(shù)據(jù)保護(hù)制度以及專利補(bǔ)償期制度這三大板塊。(見(jiàn)圖一)

圖一
2021年7月4日,國(guó)家藥監(jiān)局、國(guó)知局聯(lián)合發(fā)布了《藥品專利糾紛早期解決機(jī)制實(shí)施辦法(實(shí)行)》(以下簡(jiǎn)稱“《實(shí)施辦法》”)。2021年7月5日,最高法發(fā)布施行《最高人民法院關(guān)于審理申請(qǐng)注冊(cè)的藥品相關(guān)的專利權(quán)糾紛民事案件適用法律若干問(wèn)題的規(guī)定》(以下簡(jiǎn)稱“《審理規(guī)定》”)、國(guó)知局發(fā)布《藥品專利糾紛早期解決機(jī)制行政裁決辦法》(以下簡(jiǎn)稱“《行政裁決辦法》”)。以上三份文件的頒布標(biāo)志著我國(guó)平衡原研藥企與仿制藥企雙方利益的最后一塊制度版圖已構(gòu)建完成。
二、 專利鏈接制度為原研藥企和仿制藥企創(chuàng)設(shè)了哪些“權(quán)利義務(wù)”?
如前文所述,專利鏈接制度旨在通過(guò)設(shè)立藥品注冊(cè)與藥品專利之間的銜接渠道,增進(jìn)制藥市場(chǎng)競(jìng)爭(zhēng)狀態(tài)并降低藥品價(jià)格,從而為原研藥企和仿制藥企的并存發(fā)展建立相應(yīng)的法律協(xié)調(diào)機(jī)制。為達(dá)到這一目的,前述三份文件為兩方創(chuàng)設(shè)了基本對(duì)等的權(quán)利與義務(wù)(見(jiàn)圖二),下文將逐一展開分析。

圖二
(一) 原研藥企的權(quán)利及義務(wù)
1、專利信息登記
《實(shí)施辦法》第二條第二款明確了專利糾紛早期解決機(jī)制適用的前置程序,即專利鏈接制度僅解決已經(jīng)在中國(guó)上市藥品專利信息登記平臺(tái)(以下簡(jiǎn)稱“信息登記平臺(tái)”)登記的專利產(chǎn)生的糾紛。同時(shí),根據(jù)第四條之規(guī)定,登記主體應(yīng)在獲得藥品注冊(cè)證書后30日內(nèi)自行完成登記。另外,以下三個(gè)方面值得注意:
(1) 登記主體
根據(jù)《實(shí)施辦法》,提交上市藥品登記信息的主體應(yīng)為藥品上市許可持有人。此處的藥品上市許可持有人除包括藥品的專利權(quán)人外,還包括專利被許可方。而在專利許可的情形下,仿制藥申請(qǐng)人可以通過(guò)不同的許可方式判斷藥品上市許可持有人是否享有獨(dú)立的訴權(quán)。
(2) 可否補(bǔ)登記
實(shí)踐中,補(bǔ)登記包括以下兩種情形下:第一,對(duì)于專利鏈接制度實(shí)施之前已經(jīng)獲得專利且獲得上市批件的藥品的追溯登記;第二,完成專利信息登記后又對(duì)新獲得授權(quán)的專利的追加登記。對(duì)于第一種情形,通過(guò)對(duì)平臺(tái)中已登記藥品地檢索,絕大多數(shù)藥品獲得注冊(cè)證書與實(shí)際完成信息登記的期限間隔遠(yuǎn)大于規(guī)定的30日,由此對(duì)追溯登記給予了肯定的答復(fù)。而對(duì)于第二種情形,如果允許原研藥權(quán)利方在完成專利信息登記后不斷追加新的專利,仿制藥申請(qǐng)人將很難攻破對(duì)方的“專利長(zhǎng)青”戰(zhàn)略,從而無(wú)限延長(zhǎng)仿制藥上市時(shí)間,這將不被專利鏈接制度所允許。因此,應(yīng)當(dāng)給予追加登記以否定的答復(fù)。
(3) 可登記的專利類型
根據(jù)《實(shí)施辦法》政策解讀所載明的內(nèi)容,可登記的專利僅包括以下幾類:
|
原研藥類別 |
可登記專利類型 |
|
化學(xué)藥 |
藥物活性成分化合物專利(不含原料藥) |
|
含活性成分的藥物組合物專利 |
|
|
醫(yī)藥用途專利 |
|
|
中藥 |
中藥組合物專利 |
|
中藥提取物專利 |
|
|
醫(yī)藥用途專利 |
|
|
生物制劑 |
序列結(jié)構(gòu)專利 |
|
醫(yī)藥用途專利 |
2、保證登記信息的“三性”
《實(shí)施辦法》第四條第二款要求,藥品上市許可持有人所登記的信息應(yīng)當(dāng)與藥品相關(guān)專利信息、藥品說(shuō)明書所載明內(nèi)容以及專利保護(hù)范圍等內(nèi)容相一致。對(duì)于仿制藥申請(qǐng)人或者社會(huì)公眾針對(duì)以上信息的真實(shí)性、準(zhǔn)確性、完整性提出的異議,因及時(shí)核實(shí)并處理。同時(shí),原研藥權(quán)利方若存在不實(shí)登記或者不符合要求的登記行為,應(yīng)承擔(dān)相應(yīng)的責(zé)任。可見(jiàn),在細(xì)化性規(guī)定缺位的情況下,專利登記信息的“三性”主要依賴于上市許可持有人的自覺(jué)性。而專利信息登記作為專利鏈接制度的基礎(chǔ),其重要性不言而喻。因此,美國(guó)的公眾異議制度或加拿大的登記審查制度就具有較強(qiáng)的參考價(jià)值。
3、及時(shí)獲悉仿制藥上市申請(qǐng)及聲明
相較于《實(shí)施辦法征求意見(jiàn)稿》,正式頒布的《實(shí)施辦法》明確:仿制藥上市申請(qǐng)被受理后的10個(gè)工作日內(nèi),原研藥權(quán)利方應(yīng)當(dāng)能夠通過(guò)以下兩種方式獲悉相應(yīng)內(nèi)容:①根據(jù)藥品評(píng)審機(jī)構(gòu)在信息登記平臺(tái)公開的信息;②收到仿制藥申請(qǐng)人的紙質(zhì)和電子郵件通知。如此一來(lái),原研藥權(quán)利方可以根據(jù)仿制藥的上市申請(qǐng)及聲明類型提前制定應(yīng)對(duì)策略,尤其是能夠直接決定二者博弈勝負(fù)的第四類聲明。
4、在異議期內(nèi)針對(duì)第四類聲明提起訴訟或裁決
此處需要強(qiáng)調(diào)的是,仿制藥申請(qǐng)人的第四類聲明包含兩類:原研藥專利應(yīng)被宣告無(wú)效和仿制藥未落入專利保護(hù)范圍。而原研藥權(quán)利方僅能夠?qū)笳咛崞鹪V訟或裁決。
面對(duì)兩種不同的異議途徑,原研藥權(quán)利方應(yīng)作何選擇?綜合《實(shí)施辦法》、《審理規(guī)定》和《行政裁決辦法》的具體規(guī)定,若選擇向國(guó)務(wù)院專利行政部門提起行政裁決,仍可再向北京知產(chǎn)法院起訴。但若法院已受理立案,專利行政部門將不予受理。據(jù)此,原研藥權(quán)利方在選擇時(shí)可綜合考慮兩種途徑的終局性、審限及其他相關(guān)因素。需要注意的是,根據(jù)《審理規(guī)定》第十條,如果權(quán)利方選擇提起訴訟的,符合條件時(shí)可向人民法院申請(qǐng)行為保全,以禁止仿制藥企的生產(chǎn)、銷售及其他行為。
確定好異議方式后,權(quán)利方應(yīng)在仿制藥上市許可申請(qǐng)公開之日起45日內(nèi)盡快啟動(dòng)程序,否則將喪失主動(dòng)權(quán)。
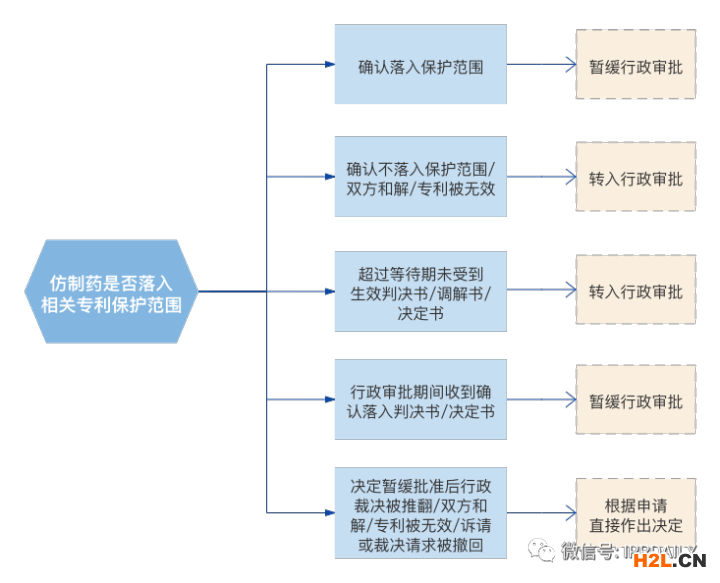
5、原研藥權(quán)利方訴訟或裁決行為將觸發(fā)國(guó)家藥監(jiān)局9個(gè)月的等待期
根據(jù)《實(shí)施辦法》第十條的規(guī)定,國(guó)家藥監(jiān)局在收到法院或?qū)@姓块T的受理通知書后,將自動(dòng)為仿制藥的注冊(cè)申請(qǐng)?jiān)O(shè)置9個(gè)月的等待期,其中:
(1) 僅原研藥權(quán)利方可觸發(fā)9個(gè)月的等待期;
(2) 僅化學(xué)藥仿制藥可設(shè)置等待期;
(3) 等待期只可設(shè)置一次,自法院立案或行政部門受理之日起算;
(4) 等待期內(nèi)國(guó)家藥監(jiān)局僅停止行政審批而不停止技術(shù)審評(píng)。
原研藥權(quán)利方或仿制藥申請(qǐng)人應(yīng)于收到判決書或決定書10個(gè)工作日內(nèi)將相應(yīng)文書報(bào)送至國(guó)家藥監(jiān)局,對(duì)通過(guò)技術(shù)審評(píng)的化學(xué)仿制藥申請(qǐng),藥監(jiān)局將結(jié)合判決或決定作出以下處理:
(二) 仿制藥企的權(quán)利及義務(wù)
1、針對(duì)信息登記平臺(tái)載明的信息作出聲明
《實(shí)施辦法》第六條向仿制藥申請(qǐng)人提出了“在提交藥品上市許可申請(qǐng)時(shí)一并提交聲明”的要求。同時(shí),專利聲明應(yīng)針對(duì)相關(guān)藥品的每一件專利分別作出。具體來(lái)看,不同類型的聲明及審批結(jié)果如下:
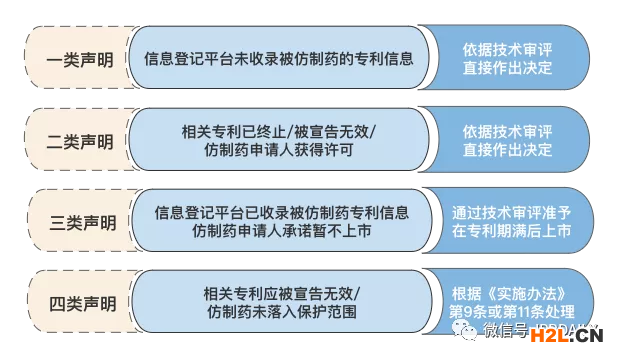
對(duì)于上述四類聲明,仿制藥申請(qǐng)人應(yīng)在全面檢索被仿制藥的相關(guān)專利狀況并結(jié)合仿制藥預(yù)估的開發(fā)及上市銷售時(shí)間后再作出。
2、保證聲明內(nèi)容的真實(shí)性
《實(shí)施辦法》第六條同樣為仿制藥申請(qǐng)人提出了自覺(jué)保證相關(guān)聲明真實(shí)性、準(zhǔn)確性的要求。需要強(qiáng)調(diào)的是,若申請(qǐng)人提出未落入相關(guān)專利保護(hù)范圍的聲明,則需要提交仿制藥的技術(shù)方案與被仿制藥品專利權(quán)利要求的相關(guān)技術(shù)對(duì)比資料。并且,一旦任何一方啟動(dòng)訴訟程序,上述資料也將作為相應(yīng)訴訟或答辯材料。
3、以書面及郵件方式告知原研藥權(quán)利方相應(yīng)申請(qǐng)及聲明
如前文所述,仿制藥企在提交上市申請(qǐng)后應(yīng)通過(guò)書面+郵件的方式履行告知義務(wù)。設(shè)置這一義務(wù)的主要原因在于能夠讓原研藥權(quán)利方第一時(shí)間獲悉仿制藥的存在并采取措施,避免原研藥企花費(fèi)大量的時(shí)間和精力監(jiān)控仿制藥的上市。
4、發(fā)起專利挑戰(zhàn)或主動(dòng)提起確認(rèn)不侵權(quán)之訴訟/裁決
(1) 啟動(dòng)專利無(wú)效宣告程序,發(fā)起專利挑戰(zhàn)。
首先,需要明確的是僅化學(xué)仿制藥可以發(fā)起專利挑戰(zhàn)。其次,基于專利無(wú)效宣告程序的一般規(guī)則,專利挑戰(zhàn)成功的時(shí)間節(jié)點(diǎn)應(yīng)以專利復(fù)審委員會(huì)審查決定作出的時(shí)間為準(zhǔn)還是以權(quán)利人啟動(dòng)司法程序后的裁判結(jié)果的生效時(shí)間為準(zhǔn)?盡管上述三份文件對(duì)此問(wèn)題均未予以明確,但本文認(rèn)為前者的時(shí)間似乎更符合專利鏈接制度的立法宗旨,即在仿制藥上市前快速解決專利糾紛。否則,專利權(quán)人一旦啟動(dòng)司法救濟(jì)程序,少則也需要再等待9個(gè)月的審限。
(2) 原研藥權(quán)利方限期未行動(dòng),仿制藥申請(qǐng)人主動(dòng)提起確之訴/裁。
根據(jù)《實(shí)施辦法》第八條第二款的規(guī)定,原研藥權(quán)利方于申請(qǐng)公開之日起45日內(nèi)未采取行動(dòng)的,仿制藥申請(qǐng)人可自行向北京知產(chǎn)法院或國(guó)務(wù)院專利行政部門提起仿制藥未落入專利保護(hù)范圍的確認(rèn)判決。但通常情況下,45日期限屆滿,原研藥權(quán)利方仍未提起訴訟或裁決的,國(guó)家藥監(jiān)局將直接開始行政審批程序,仿制藥申請(qǐng)人似乎沒(méi)有必要再花費(fèi)額外的成本進(jìn)行訴訟或裁決。
除此之外,《審理規(guī)定》第七條賦予仿制藥申請(qǐng)人在提起訴訟時(shí)擴(kuò)大訴請(qǐng)范圍的權(quán)利,即仿制藥申請(qǐng)人可主張已上市藥品的專利屬于現(xiàn)有技術(shù)或仿制藥申請(qǐng)人享有先用權(quán),并請(qǐng)求法院綜合審查后再作出相應(yīng)的確認(rèn)判決。
5、首個(gè)挑戰(zhàn)專利成功的化學(xué)仿制藥將獲得12個(gè)月的市場(chǎng)獨(dú)占期
與原研藥權(quán)利方觸發(fā)9個(gè)月的等待期相類似,首仿藥挑戰(zhàn)成功后,也將獲得12個(gè)月獨(dú)占期限。在此期限內(nèi),仿制藥不僅可以與原研藥共同分割藥品市場(chǎng),還可以阻礙國(guó)家藥監(jiān)局批準(zhǔn)同品種仿制藥上市。盡管專利挑戰(zhàn)難度不小,但是對(duì)于仿制藥企業(yè)能夠盡快在激烈的市場(chǎng)競(jìng)爭(zhēng)中搶占一席之地的激勵(lì)性同樣也不小。
三、結(jié)語(yǔ)
總體而言,專利鏈接制度的核心價(jià)值在于鼓勵(lì)當(dāng)事人雙方將專利糾紛提前至藥品上市階段,避免仿制藥上市之后因?qū)@麢?quán)屬糾紛而影響雙方的銷售盈利。除了制度指引和支持,專利鏈接制度也為我國(guó)的藥品企業(yè)帶來(lái)了新的機(jī)遇與挑戰(zhàn)。盡管相應(yīng)制度的建立無(wú)法停止原研藥企與仿制藥企之間的博弈,但只有在保證雙方競(jìng)爭(zhēng)地位對(duì)等的前提下,二者的博弈才能激發(fā)出更有價(jià)值的創(chuàng)新。

注釋:
[1] “專利懸崖”是對(duì)藥品專利保護(hù)期屆滿帶來(lái)的專利藥品銷售和利潤(rùn)的大幅下降的形象比喻,將專利保護(hù)期屆滿時(shí)的界限形象比喻為懸崖。
中企檢測(cè)認(rèn)證網(wǎng)提供iso體系認(rèn)證機(jī)構(gòu)查詢,檢驗(yàn)檢測(cè)、認(rèn)證認(rèn)可、資質(zhì)資格、計(jì)量校準(zhǔn)、知識(shí)產(chǎn)權(quán)貫標(biāo)一站式行業(yè)企業(yè)服務(wù)平臺(tái)。中企檢測(cè)認(rèn)證網(wǎng)為檢測(cè)行業(yè)相關(guān)檢驗(yàn)、檢測(cè)、認(rèn)證、計(jì)量、校準(zhǔn)機(jī)構(gòu),儀器設(shè)備、耗材、配件、試劑、標(biāo)準(zhǔn)品供應(yīng)商,法規(guī)咨詢、標(biāo)準(zhǔn)服務(wù)、實(shí)驗(yàn)室軟件提供商提供包括品牌宣傳、產(chǎn)品展示、技術(shù)交流、新品推薦等全方位推廣服務(wù)。這個(gè)問(wèn)題就給大家解答到這里了,如還需要了解更多專業(yè)性問(wèn)題可以撥打中企檢測(cè)認(rèn)證網(wǎng)在線客服13550333441。為您提供全面檢測(cè)、認(rèn)證、商標(biāo)、專利、知識(shí)產(chǎn)權(quán)、版權(quán)法律法規(guī)知識(shí)資訊,包括商標(biāo)注冊(cè)、食品檢測(cè)、第三方檢測(cè)機(jī)構(gòu)、網(wǎng)絡(luò)信息技術(shù)檢測(cè)、環(huán)境檢測(cè)、管理體系認(rèn)證、服務(wù)體系認(rèn)證、產(chǎn)品認(rèn)證、版權(quán)登記、專利申請(qǐng)、知識(shí)產(chǎn)權(quán)、檢測(cè)法、認(rèn)證標(biāo)準(zhǔn)等信息,中企檢測(cè)認(rèn)證網(wǎng)為檢測(cè)認(rèn)證商標(biāo)專利從業(yè)者提供多種檢測(cè)、認(rèn)證、知識(shí)產(chǎn)權(quán)、版權(quán)、商標(biāo)、專利的轉(zhuǎn)讓代理查詢法律法規(guī),咨詢輔導(dǎo)等知識(shí)。
本文內(nèi)容整合網(wǎng)站:中國(guó)政府網(wǎng)、百度百科、搜狗百科、360百科、最高人民法院、知乎、市場(chǎng)監(jiān)督總局 、國(guó)家知識(shí)產(chǎn)權(quán)局、國(guó)家商標(biāo)局
免責(zé)聲明:本文部分內(nèi)容根據(jù)網(wǎng)絡(luò)信息整理,文章版權(quán)歸原作者所有。向原作者致敬!發(fā)布旨在積善利他,如涉及作品內(nèi)容、版權(quán)和其它問(wèn)題,請(qǐng)跟我們聯(lián)系刪除并致歉!
本文來(lái)源: http://www.rumin8raps.com/news/202108/xwif_18999.html






