藥品和醫(yī)療器械市場準(zhǔn)入專項(xiàng)扶持計(jì)劃
在線申報時間:長期有效
本次專項(xiàng)扶持計(jì)劃圍繞在國內(nèi)外進(jìn)行臨床試驗(yàn)或取得注冊上市資格的創(chuàng)新藥物、醫(yī)療器械產(chǎn)品進(jìn)行資助,包含藥品臨床試驗(yàn)及審批扶持計(jì)劃、醫(yī)療器械注冊認(rèn)證扶持計(jì)劃共兩類。項(xiàng)目一經(jīng)審核通過后,將最高給予10000萬元的資金資助。
一、藥品臨床試驗(yàn)及審批扶持計(jì)劃
(一)扶持范圍
1.按照國家藥監(jiān)局頒布的《藥品注冊管理辦法》(國家市場監(jiān)督管理總局第27號令)及相關(guān)注冊分類細(xì)則規(guī)定,取得國內(nèi)藥物臨床試驗(yàn)批件或完成I、II、III期臨床試驗(yàn)的第1-2類化學(xué)藥、第1-2類生物制品、第1-2類中藥及天然藥物。
2.在深圳本地完成研發(fā)并通過美國食品藥品監(jiān)督局(FDA)頒布的《聯(lián)邦食品、藥品和化妝品法案》中505(b)(1)、505(b)(2)說明的途徑進(jìn)行審批的藥品。
3.在深圳本地完成研發(fā)并通過歐盟適用的《歐洲藥品注冊管理辦法》中的集中程序CP進(jìn)行審批的藥品。
(二)扶持方式及資助金額
事后資助。
1.對第1類化學(xué)藥、1類生物制品、1類中藥及天然藥物,按經(jīng)項(xiàng)目評審報告核定費(fèi)用的40%予以資助:取得臨床批件的,給予最高不超過800萬資助;完成I、II、III期臨床試驗(yàn)的,分別最高不超過1000、2000、3000萬元;對于委托深圳市經(jīng)認(rèn)定的臨床試驗(yàn)研發(fā)外包機(jī)構(gòu)(CRO)或在深圳市醫(yī)療機(jī)構(gòu)開展臨床試驗(yàn)的,資助上限再分別提高200萬元。
2.對第2類化學(xué)藥、2類生物制品、2類中藥及天然藥物,按經(jīng)項(xiàng)目評審報告核定費(fèi)用的40%予以資助:取得臨床批件的,給予最高不超過200萬資助;完成I、II、III期臨床試驗(yàn)的,分別最高不超過300、800、1500萬元;對于委托深圳市經(jīng)認(rèn)定的臨床試驗(yàn)研發(fā)外包機(jī)構(gòu)(CRO)或在深圳市醫(yī)療機(jī)構(gòu)開展臨床試驗(yàn)的,資助上限再分別提高200萬元。
3.對成功通過美國FDA注冊上市或歐盟集中程序CP審批上市的藥品,按經(jīng)專業(yè)審計(jì)機(jī)構(gòu)審計(jì)后確認(rèn)的費(fèi)用給予全額資助,最高不超過500萬元。
4.以上資助金額按照品種獨(dú)立核定。企業(yè)若有多個藥物品種符合申報要求的應(yīng)當(dāng)以每個品種作為獨(dú)立項(xiàng)目申報。單個企業(yè)每年獲得資助金額最高不超過1億元。
(三)申報時限及審理流程
1.申報時限:長期有效,我委將結(jié)合項(xiàng)目申報情況,分批次集中開展審核工作。
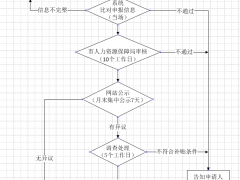
2.審理流程:項(xiàng)目申報—項(xiàng)目初審—第三方評審機(jī)構(gòu)評審—征求各部門意見—公示—下達(dá)扶持計(jì)劃—下達(dá)項(xiàng)目批復(fù)
(四)申報單位基本條件
1.項(xiàng)目申報單位是在深圳市(含深汕特別合作區(qū))注冊、具備獨(dú)立法人資格的從事藥品研發(fā)、生產(chǎn)的企業(yè)。
(五)申報要求
1.申報項(xiàng)目對應(yīng)的藥品取得符合扶持范圍規(guī)定成果(如取得臨床批件,或完成臨床試驗(yàn)并取得臨床試驗(yàn)總結(jié)報告,或通過國內(nèi)外藥品監(jiān)管部門審批注冊)的時間應(yīng)當(dāng)在提交申報之日前兩年內(nèi)。
2.藥物臨床注冊批件需為首次取得。
3.已獲得我委“新產(chǎn)品新技術(shù)示范應(yīng)用推廣扶持計(jì)劃”、“國際市場準(zhǔn)入認(rèn)證扶持計(jì)劃”資助的同一藥品的同一階段成果不得再次申報本扶持計(jì)劃。
二、醫(yī)療器械注冊認(rèn)證扶持計(jì)劃
(一)扶持范圍
1.按照國家藥監(jiān)局最新修訂頒布的《醫(yī)療器械分類目錄》規(guī)定并按照常規(guī)渠道申報獲批的第二、三類醫(yī)療器械,以及按照《創(chuàng)新醫(yī)療器械特別審查程序》(國家藥品監(jiān)督管理局2018年第83號)通過特別審批渠道申報獲批的第二、三類創(chuàng)新醫(yī)療器械。
2.在深圳本地完成研發(fā)并通過美國食品藥品監(jiān)督局(FDA)《聯(lián)邦食品、藥品和化妝品法案》中515條規(guī)定的獲得上市前批準(zhǔn)PMA的Ⅲ類醫(yī)療器械,或者按照上市前通知510(k)程序取得510(k)銷售許可編號的醫(yī)療器械。
,專注政府扶持項(xiàng)目咨詢十余載,是國內(nèi)專業(yè)的中小企業(yè)綜合服務(wù)運(yùn)營商,如果您的企業(yè)想要申報高新技術(shù)企業(yè)認(rèn)定、政府項(xiàng)目補(bǔ)貼申報、企業(yè)貫標(biāo)、國內(nèi)外專利申請、商標(biāo)注冊等知識產(chǎn)權(quán)相關(guān)項(xiàng)目申報,卻遇到許多難關(guān),不知道申報條件、不熟悉申報流程、不了解申報關(guān)鍵、不清楚能否通過等,請聯(lián)系,這些困難由我們幫您解決。如果想要提高申報成功率,也請聯(lián)系。
3.在深圳本地完成研發(fā)并按照歐盟醫(yī)療器械注冊有關(guān)規(guī)定(舊版《歐洲醫(yī)療器械指令(MDD)》(93/42/EEC)、《有源植入醫(yī)療器械指令(AIMDD)》(90/385/EEC))、新版《醫(yī)療器械法規(guī)(MDR)》(EU2017/745))取得歐盟授權(quán)NB機(jī)構(gòu)頒發(fā)認(rèn)證并在歐盟地區(qū)上市的第IIa、IIb類、第III類醫(yī)療器械;或按照歐盟體外診斷器械注冊有關(guān)規(guī)定(舊版《體外診斷醫(yī)療器械指令(IVDD)》(98/79/EC)、新版《體外診斷器械法規(guī)(IVDR)》(EU2017/746))取得歐盟授權(quán)NB機(jī)構(gòu)頒發(fā)認(rèn)證并在歐盟地區(qū)上市的體外診斷產(chǎn)品。
(二)扶持方式及資助金額
事后資助。
1.對按照常規(guī)渠道申報獲批的第二、三類醫(yī)療器械產(chǎn)品,按經(jīng)項(xiàng)目評審報告核定費(fèi)用的40%給予事后資助,最高不超過200、300萬元;對按照特別審批渠道申報獲批的第二、三類創(chuàng)新醫(yī)療器械產(chǎn)品,按經(jīng)項(xiàng)目評審報告核定費(fèi)用的40%給予事后資助,最高分別不超過300、500萬元。
2.對成功通過美國FDA的PMA途徑申請注冊的III類醫(yī)療器械,按經(jīng)專業(yè)審計(jì)機(jī)構(gòu)審計(jì)后確認(rèn)的費(fèi)用給予資助,最高不超過500萬元。對按照美國FDA上市前通知510(k)程序取得510(k)銷售許可編號的醫(yī)療器械,按經(jīng)專業(yè)審計(jì)機(jī)構(gòu)審計(jì)后確認(rèn)的費(fèi)用給予資助,最高不超過300萬元。
3.對按照舊版歐洲醫(yī)療器械指令、有源植入醫(yī)療器械指令取得歐盟授權(quán)NB機(jī)構(gòu)頒發(fā)認(rèn)證并在歐盟地區(qū)上市的第IIa、IIb類、第III類醫(yī)療器械,按經(jīng)專業(yè)審計(jì)機(jī)構(gòu)審計(jì)后確認(rèn)的費(fèi)用給予資助,最高分別不超過100、200、300萬元;對按照舊版體外診斷醫(yī)療器械指令取得歐盟授權(quán)NB機(jī)構(gòu)頒發(fā)認(rèn)證并在歐盟地區(qū)上市的體外診斷產(chǎn)品,按經(jīng)專業(yè)審計(jì)機(jī)構(gòu)審計(jì)后確認(rèn)的費(fèi)用給予資助,最高不超過100萬元。
對按照新版醫(yī)療器械法規(guī)取得歐盟授權(quán)NB機(jī)構(gòu)頒發(fā)認(rèn)證并在歐盟地區(qū)上市的第IIa、IIb類、III類醫(yī)療器械,按經(jīng)專業(yè)審計(jì)機(jī)構(gòu)審計(jì)后確認(rèn)的費(fèi)用給予資助,最高分別不超過200、300、500萬元;對按照新版體外診斷醫(yī)療器械法規(guī)取得歐盟授權(quán)NB機(jī)構(gòu)頒發(fā)認(rèn)證并在歐盟地區(qū)上市的體外診斷產(chǎn)品,按經(jīng)專業(yè)審計(jì)機(jī)構(gòu)審計(jì)后確認(rèn)的費(fèi)用給予資助,最高不超過300萬元。
4.以上資助金額按照產(chǎn)品獨(dú)立核定。企業(yè)若有多個醫(yī)療器械產(chǎn)品符合申報要求的應(yīng)當(dāng)以每個產(chǎn)品作為獨(dú)立項(xiàng)目申報。單個企業(yè)每年獲得資助金額最高不超過3000萬元。
(三)申報時限及審理流程
1.申報時限:長期有效,我委將結(jié)合項(xiàng)目申報情況,分批次集中開展審核工作。
2.審理流程:項(xiàng)目申報—項(xiàng)目初審—第三方評審機(jī)構(gòu)評審—征求各部門意見—公示—下達(dá)扶持計(jì)劃—下達(dá)項(xiàng)目批復(fù)
(四)申報單位基本條件
1.項(xiàng)目申報單位是在深圳市(含深汕特別合作區(qū))注冊、具備獨(dú)立法人資格的從事醫(yī)療器械研發(fā)、生產(chǎn)的企業(yè)。
(五)申報要求
1.申報項(xiàng)目對應(yīng)的醫(yī)療器械取得國內(nèi)產(chǎn)品注冊證或獲得FDA、CE市場準(zhǔn)入的時間應(yīng)當(dāng)在提交申報之日前兩年內(nèi)。
2.醫(yī)療器械產(chǎn)品注冊證需為首次取得。
3.已獲得我委“新產(chǎn)品新技術(shù)示范應(yīng)用推廣扶持計(jì)劃”、“國際市場準(zhǔn)入認(rèn)證扶持計(jì)劃”資助的同一醫(yī)療器械產(chǎn)品不得再次申報本扶持計(jì)劃。
注意事項(xiàng)
以上資助金額按照產(chǎn)品獨(dú)立核定。企業(yè)若有多個藥物品或醫(yī)療器械產(chǎn)品符合申報要求的應(yīng)當(dāng)以每個產(chǎn)品作為獨(dú)立項(xiàng)目申報。對藥品臨床試驗(yàn)及審批的扶持,單個企業(yè)每年獲得資助金額最高不超過1億元;對醫(yī)療器械注冊認(rèn)證的扶持,單個企業(yè)每年獲得資助金額最高不超過3000萬元。
,專注政府扶持項(xiàng)目咨詢十余載,是國內(nèi)專業(yè)的中小企業(yè)綜合服務(wù)運(yùn)營商,如果您的企業(yè)想要申報高新技術(shù)企業(yè)認(rèn)定、政府項(xiàng)目補(bǔ)貼申報、企業(yè)貫標(biāo)、國內(nèi)外專利申請、商標(biāo)注冊等知識產(chǎn)權(quán)相關(guān)項(xiàng)目申報,卻遇到許多難關(guān),不知道申報條件、不熟悉申報流程、不了解申報關(guān)鍵、不清楚能否通過等,請聯(lián)系,這些困難由我們幫您解決。如果想要提高申報成功率,也請聯(lián)系。
中企檢測認(rèn)證網(wǎng)提供iso體系認(rèn)證機(jī)構(gòu)查詢,檢驗(yàn)檢測、認(rèn)證認(rèn)可、資質(zhì)資格、計(jì)量校準(zhǔn)、知識產(chǎn)權(quán)貫標(biāo)一站式行業(yè)企業(yè)服務(wù)平臺。中企檢測認(rèn)證網(wǎng)為檢測行業(yè)相關(guān)檢驗(yàn)、檢測、認(rèn)證、計(jì)量、校準(zhǔn)機(jī)構(gòu),儀器設(shè)備、耗材、配件、試劑、標(biāo)準(zhǔn)品供應(yīng)商,法規(guī)咨詢、標(biāo)準(zhǔn)服務(wù)、實(shí)驗(yàn)室軟件提供商提供包括品牌宣傳、產(chǎn)品展示、技術(shù)交流、新品推薦等全方位推廣服務(wù)。這個問題就給大家解答到這里了,如還需要了解更多專業(yè)性問題可以撥打中企檢測認(rèn)證網(wǎng)在線客服13550333441。為您提供全面檢測、認(rèn)證、商標(biāo)、專利、知識產(chǎn)權(quán)、版權(quán)法律法規(guī)知識資訊,包括商標(biāo)注冊、食品檢測、第三方檢測機(jī)構(gòu)、網(wǎng)絡(luò)信息技術(shù)檢測、環(huán)境檢測、管理體系認(rèn)證、服務(wù)體系認(rèn)證、產(chǎn)品認(rèn)證、版權(quán)登記、專利申請、知識產(chǎn)權(quán)、檢測法、認(rèn)證標(biāo)準(zhǔn)等信息,中企檢測認(rèn)證網(wǎng)為檢測認(rèn)證商標(biāo)專利從業(yè)者提供多種檢測、認(rèn)證、知識產(chǎn)權(quán)、版權(quán)、商標(biāo)、專利的轉(zhuǎn)讓代理查詢法律法規(guī),咨詢輔導(dǎo)等知識。
本文內(nèi)容整合網(wǎng)站:中國政府網(wǎng)、百度百科、最高人民法院、知乎、國家認(rèn)證認(rèn)可監(jiān)督管理委員會、國家知識產(chǎn)權(quán)局、市場監(jiān)督總局
免責(zé)聲明:本文部分內(nèi)容根據(jù)網(wǎng)絡(luò)信息整理,文章版權(quán)歸原作者所有。向原作者致敬!發(fā)布旨在積善利他,如涉及作品內(nèi)容、版權(quán)和其它問題,請跟我們聯(lián)系刪除并致歉!