原標題:匯業(yè)IP評論 |中國藥品專利鏈接制度初落地,如何打好司法行政組合拳?
2021年6月1日實施的《專利法》正式將藥品專利鏈接制度寫入了法律,之后相關部門在2021年7月4日和5日發(fā)布了一系列與藥品專利鏈接制度配套的文件和司法解釋,
引言
2021年6月1日實施的《專利法》正式將藥品專利鏈接制度寫入了法律,其第七十六條記載了:藥品上市審評審批過程中,藥品上市許可申請人與有關專利權人或者利害關系人,因申請注冊的藥品相關的專利權產(chǎn)生糾紛的,相關當事人可以向人民法院起訴,請求就申請注冊的藥品相關技術方案是否落入他人藥品專利權保護范圍作出判決。國務院藥品監(jiān)督管理部門在規(guī)定的期限內(nèi),可以根據(jù)人民法院生效裁判作出是否暫停批準相關藥品上市的決定。
藥品上市許可申請人與有關專利權人或者利害關系人也可以就申請注冊的藥品相關的專利權糾紛,向國務院專利行政部門請求行政裁決。
國務院藥品監(jiān)督管理部門會同國務院專利行政部門制定藥品上市許可審批與藥品上市許可申請階段專利權糾紛解決的具體銜接辦法,報國務院同意后實施。
之后相關部門在2021年7月4日和5日發(fā)布了一系列與藥品專利鏈接制度配套的文件和司法解釋,包括:《藥品專利糾紛早期解決機制實施辦法(試行)》(以下簡稱《實施辦法》)、《實施辦法》政策解讀、《最高人民法院關于審理申請注冊的藥品相關的專利權糾紛民事案件適用法律若干問題的規(guī)定》(以下簡稱《藥品專利權糾紛司法解釋》)和《藥品專利糾紛早期解決機制行政裁決辦法》(以下簡稱《行政裁決辦法》),標志著我國司法行政雙軌制的藥品專利鏈接制度正式落地施行。隨后引發(fā)了企業(yè)界、法律界、學術界的關注和討論。本文嘗試在梳理以上文件的基礎上,對我國的藥品專利鏈接制度的實施框架做簡單分析,并對仿制藥企業(yè)和原研藥企業(yè)給出幾點建議。
一、《實施辦法》對我國的藥品專利鏈接制度的實施作出了具體規(guī)定
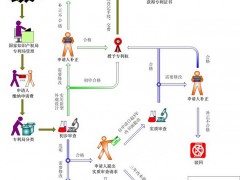
《實施辦法》對登記、聲明、公開、通知、通過司法途徑或行政途徑解決藥品專利糾紛、設置9個月等待期、結(jié)合判決書/決定書作出處理、雙首仿藥的市場獨占期、上市后糾紛解決和上市許可效力等環(huán)節(jié)都作出了具體規(guī)定(見圖1)。

圖1 《實施辦法》相關內(nèi)容的主體結(jié)構流程圖
其中,《實施辦法》第六條列出了聲明分為四類:
一類聲明:中國上市藥品專利信息登記平臺中沒有被仿制藥的相關專利信息;
二類聲明:中國上市藥品專利信息登記平臺收錄的被仿制藥相關專利權已終止或者被宣告無效,或者仿制藥申請人已獲得專利權人相關專利實施許可;
三類聲明:中國上市藥品專利信息登記平臺收錄有被仿制藥相關專利,仿制藥申請人承諾在相應專利權有效期屆滿之前所申請的仿制藥暫不上市;
四類聲明:中國上市藥品專利信息登記平臺收錄的被仿制藥相關專利權應當被宣告無效,或者其仿制藥未落入相關專利權保護范圍。
《實施辦法》第九條列出了結(jié)合判決書/決定書作出處理的五種情形:
(一)確認落入相關專利權保護范圍的,待專利權期限屆滿前將相關化學仿制藥注冊申請轉(zhuǎn)入行政審批環(huán)節(jié);
(二)確認不落入相關專利權保護范圍或者雙方和解的,按照程序?qū)⑾嚓P化學仿制藥注冊申請轉(zhuǎn)入行政審批環(huán)節(jié);
(三)相關專利權被依法無效的,按照程序?qū)⑾嚓P化學仿制藥注冊申請轉(zhuǎn)入行政審批環(huán)節(jié);
(四)超過等待期,國務院藥品監(jiān)督管理部門未收到人民法院的生效判決或者調(diào)解書,或者國務院專利行政部門的行政裁決,按照程序?qū)⑾嚓P化學仿制藥注冊申請轉(zhuǎn)入行政審批環(huán)節(jié);
(五)國務院藥品監(jiān)督管理部門在行政審批期間收到人民法院生效判決或者國務院專利行政部門行政裁決,確認落入相關專利權保護范圍的,將相關化學仿制藥注冊申請交由國家藥品審評機構按照本條第二款第一項的規(guī)定辦理。
二、《行政裁決辦法》的主要內(nèi)容和分析
《行政裁決辦法》規(guī)定了設立藥品專利糾紛早期解決機制行政裁決委員會組織和開展藥品專利糾紛早期解決機制行政裁決相關工作;滿足行政裁決的條件;請求主體資格;適格的被請求人;提交請求書及相關材料的要求;材料補正;不受理情形;立案;組合議組審理;視撤與缺席審理;國知局無效宣告的效力;調(diào)解;中止事由;作出是否落入專利權保護范圍的裁決;不服可向法院提起訴訟(見圖2)。

圖2 《行政裁決辦法》相關內(nèi)容的主體結(jié)構流程圖
《專利法》第七十六條第一款與第二款分別規(guī)定了藥品上市審評審批過程中,藥品上市許可申請人與有關專利權人或者利害關系人,因申請注冊的藥品相關的專利權產(chǎn)生糾紛的,相關當事人可以向人民法院起訴也可以向國務院專利行政部門請求行政裁決。這明確了藥品專利糾紛早期解決機制既可以走司法救濟途徑,也可以走行政救濟途徑。兩種途徑各有優(yōu)劣,本文僅對行政救濟途徑在實踐中可能遇到的情形進行分析,希望企業(yè)在選擇具體救濟途徑時,本文能起到一定的參考作用。
結(jié)合《行政裁決辦法》以及《實施辦法》可以看出:
1)國家知識產(chǎn)權局做出的無效宣告決定會切實影響其行政裁決決定的做出,雖然宣告無效后仍可能出現(xiàn)行政訴訟,但是訴訟期間,除四種情形外,不停止行政行為的執(zhí)行(《行政訴訟法》第56條)。其中一種情形是原告或者利害關系人申請停止執(zhí)行,人民法院認為該行政行為的執(zhí)行會造成難以彌補的損失,并且停止執(zhí)行不損害國家利益、社會公共利益的。在藥品相關專利被無效后提起行政訴訟期間,估計這種情形會比較多,這需要申請停止執(zhí)行人(即原研藥企業(yè))提供證據(jù)證明執(zhí)行會造成難以彌補的損失。
2)國家藥品審評機構要結(jié)合該行政裁決作出相應處理。若行政裁決之后,當事人不服提起訴訟,但9個月等待期內(nèi)沒有拿到生效判決,那么國家藥品審評機構將如何結(jié)合該行政裁決作出相應處理呢?由于該制度剛剛施行,沒有先例,具體如何操作還有待于在實踐中摸索。
3)國家知識產(chǎn)權局設立專門的部門(藥品專利糾紛早期解決機制行政裁決委員會)處理此類行政裁決事宜。由專門部門處理此類事務,對時間控制,標準統(tǒng)一性都會有所幫助。
4)人民法院未立案是行政裁決申請被受理立案的前提條件;但反過來不是,即國家知識產(chǎn)權局已受理并開展行政裁決工作的,不影響人民法院的審判工作(見《藥品專利權糾紛司法解釋》第五條)。這體現(xiàn)了司法途徑是人民維護自身權益的最后一道防線的思想理念。
5)當事人不服行政裁決的,可以依法向人民法院起訴。行政裁決可以從一定程度上緩解司法資源緊張的局面,對一些簡單、法律關系清晰明了的案件提供了一個專業(yè)的快速通道。復雜的、爭議大的案件,即使在走完行政裁決后,依然免不了用司法途徑來解決糾紛。
三、對《實施辦法》第十一條“對首個挑戰(zhàn)專利成功并首個獲批上市的化學仿制藥,給予市場獨占期”的理解
獲得市場獨占期,需要以兩個首次作為條件,缺一不可。
依據(jù)《實施辦法》第十一條第二款對挑戰(zhàn)專利成功的定義,挑戰(zhàn)專利成功是指化學仿制藥申請人提交四類聲明,且根據(jù)其提出的宣告專利權無效請求,相關專利權被宣告無效,因而使仿制藥可獲批上市。即挑戰(zhàn)專利成功不包括因其仿制藥未落入相關專利權保護范圍而獲批上市的情形。這就導致了可能出現(xiàn)首個挑戰(zhàn)專利成功但不是首個獲批上市的情況。例如:A企業(yè)提出四類聲明只針對其仿制藥未落入相關專利權保護范圍。隨后,A企業(yè)通過提起訴訟或者申請行政裁決,確認其仿制藥未落入相關專利權保護范圍且符合審評審批條件,成為首個獲批上市的化學仿制藥申請企業(yè)。這種情形下,若B企業(yè)通過發(fā)起挑戰(zhàn)專利成功,即使成為了首個挑戰(zhàn)專利成功的化學仿制藥申請企業(yè),也無法享有市場獨占期。
另外,需要探討的是,挑戰(zhàn)專利成功中相關專利權被宣告無效,指的是信息平臺上相關藥物登記的所有相關專利的專利權被宣告無效,還是指其中一件專利的專利權被宣告無效?如果是指所有相關專利的專利權被宣告無效,會使得挑戰(zhàn)專利成功的難度非常大,從而有可能導致12個月的獨占期形同虛設。
筆者更偏向于挑戰(zhàn)專利成功指其中一件專利的專利權被宣告無效。如果是這種情形,那么假設原研藥企業(yè)依法登記了多件專利。兩家仿制藥企業(yè)分別對其中1件專利提出無效宣告請求,且均先后挑戰(zhàn)專利成功,那么最先挑戰(zhàn)成功的即首次挑戰(zhàn)專利成功的企業(yè)。但是如果那家首次挑戰(zhàn)專利成功的企業(yè),并沒有首個獲批上市,那么也不能享受12個月的獨占期。或者會不會存在這兩家仿制藥申請企業(yè)均被作為首次挑戰(zhàn)專利成功的企業(yè)呢?因為單獨對于其挑戰(zhàn)的專利來說,這兩家仿制藥申請企業(yè)均是第一個挑戰(zhàn)該專利成功的企業(yè)。由于存在以上幾種關于“首次挑戰(zhàn)專利成功”的理解,因此筆者認為還需要對《實施辦法》進一步細化,或者在實踐過程中對“首次挑戰(zhàn)專利成功”這個概念進行解釋和明確。
相比美國的藥品專利鏈接制度,雖然美國的獨占期只有180天,但是僅要求是第一申請人即可,相當于只需要滿足一個首次——首個獲批上市的仿制藥申請人(《美國法典》第21編第355(j)(5)(B)(iv)(II)(bb)條),可見仿制藥申請人在美國獲得市場獨占期相比在中國會更容易。
四、至關重要的專利無效宣告
事實上,專利糾紛的根本在于專利權的存在基礎。如果不存在專利權,那么專利糾紛的基石就沒有了,也就不會發(fā)生專利糾紛。因此,一直以來圍繞專利權是否應當被宣告無效就是雙方當事人的爭議焦點。《專利法》第四十五條規(guī)定了自國務院專利行政部門公告授予專利權之日起,任何單位或者個人認為該專利權的授予不符合本法有關規(guī)定的,可以請求國務院專利行政部門宣告該專利權無效。無論國務院專利行政部門作出宣告專利權無效、部分專利權無效或者維持專利權的決定,只要當事人不服該決定的,均可自收到通知之日起三個月內(nèi)向人民法院提起行政訴訟。人民法院應當通知無效宣告請求程序的對方當事人作為第三人參加訴訟(見《專利法》第四十六條第二款)。我國行政訴訟、民事訴訟均適用兩審終審制。一審的審查期限一般是6個月,二審的審查期限一般是3個月,且中間還有相關文書流轉(zhuǎn)時間,因此獲得法院的生效判決的時間一般需要11個月。同樣的,藥品專利糾紛若采用司法救濟途徑,按照普通流程獲得法院的生效判決的時間一般也需要11個月。因此,在《實施辦法》規(guī)定的9個月等待期內(nèi)做出生效判決對于法院而言無疑是較大的挑戰(zhàn),需要法院內(nèi)部協(xié)調(diào)機制,優(yōu)化流程,加快審判。
五、對仿制藥企業(yè)和原研藥企業(yè)的建議
1、對于仿制藥企業(yè),在項目立項、研究開發(fā)、上市申請階段可以通過FTO盡職調(diào)查,尤其是針對中國上市藥品專利信息登記平臺(以下簡稱信息平臺)上登記的原研藥相關專利進行侵權比對分析,了解仿制藥相關的各技術方案落入相關專利權保護范圍的風險程度,從而規(guī)劃好規(guī)避方案、無效策略和外圍專利布局。對風險大的專利委托律所或者專利代理機構等第三方機構進行無效檢索和分析,為發(fā)起專利無效做好準備,并爭取拿到專利挑戰(zhàn)成功首仿藥的1年市場獨占期。這將極大促進國內(nèi)仿制藥企業(yè)積極研究以專利挑戰(zhàn)模式及早布局首仿的熱情,有利于提高仿制藥企業(yè)研發(fā)質(zhì)量。
2、對于原研藥企業(yè),首先盡早做好專利布局,從核心專利(比如活性成分API的化合物結(jié)構)到外圍專利(比如化合物結(jié)構改造、新劑型、晶型、制備工藝或方法、組合物等等)。可以在拿到第一批實驗數(shù)據(jù)的情況下提出專利申請,后續(xù)完整數(shù)據(jù)出來后再以在先優(yōu)先權為基礎完善申請文件后遞交新申請。由于化學藥受專利影響非常大,一旦失去專利權保護,其銷售額很可能出現(xiàn)斷崖式下降。在我國推行藥品專利鏈接制度后,登記到平臺上的專利面臨專利挑戰(zhàn)的可能極大。這更要求原研藥企業(yè)在開始專利撰寫時,一定要注意專利撰寫質(zhì)量,尤其是專利權的穩(wěn)定性,設置合理的保護范圍,給予足夠的實施例支持,從多角度對核心藥品進行全方位保護,防止競爭對手繞過該專利。通過PCT或者巴黎公約,同時布局全球?qū)@绕涫撬幤返闹匾袌龅氐膶@季帧?/p>

其次,原研藥企業(yè)可以實時監(jiān)控信息平臺上公開的相關仿制藥聲明、相關仿制藥申請信息,尤其是四類聲明。一旦發(fā)現(xiàn)四類聲明,原研藥企業(yè)要盡快利用45天的時間期限做好專利侵權比對,確定是否提起訴訟或者申請行政裁決,并確定采取哪種救濟途徑。
最后,原研藥企業(yè)還可以考慮對登記到信息平臺的專利進行投保,以便通過專利保險途徑來分擔由四類聲明帶來的維權費用。
六、結(jié)束語
藥品專利糾紛早期解決機制在實施過程中會遇到哪些問題,應當如何解決,正處于摸著石頭過河階段,可能還需要施行一段時間之后才能明晰。但總的來說,藥品專利糾紛早期解決機制的實施,司法途徑和行政途徑的“組合拳”,既有利于保護藥品專利權人合法權益,鼓勵新藥研究和促進高水平仿制藥發(fā)展,有利于創(chuàng)新藥和仿制藥的規(guī)范發(fā)展,又有利于我國專利制度的完善,專利質(zhì)量的提升,專利技術的轉(zhuǎn)化,專利保險的發(fā)展,以及更好的知識產(chǎn)權維權環(huán)境的營造。
相關法律、司法解釋、其他規(guī)范性文件和信息:
1、《中華人民共和國專利法》(以下簡稱《專利法》)根據(jù)第十三屆全國人民代表大會常務委員會第二十二次會議2020年10月17日第四次修正,于2021年6月1日起施行。
2、《藥品專利糾紛早期解決機制實施辦法(試行)》(以下簡稱《實施辦法》)由國家藥監(jiān)局、國家知識產(chǎn)權局組織制定,于2021年7月4日正式發(fā)布,自發(fā)布之日起施行。
3、《藥品專利糾紛早期解決機制實施辦法(試行)》政策解讀(以下簡稱《實施辦法》政策解讀)由國家藥監(jiān)局、國家知識產(chǎn)權局于《實施辦法》同日發(fā)布。
4、《最高人民法院關于審理申請注冊的藥品相關的專利權糾紛民事案件適用法律若干問題的規(guī)定》(以下簡稱《藥品專利權糾紛司法解釋》)于2021年5月24日由最高人民法院審批委員會第1839次會議通過,2021年7月4日公布,自2021年7月5日起施行。
5、《藥品專利糾紛早期解決機制行政裁決辦法》(以下簡稱《行政裁決辦法》)由國家知識產(chǎn)權局2021年7月5日發(fā)布,自發(fā)布之日起施行。
6、中國上市藥品專利信息登記平臺(以下簡稱信息平臺)網(wǎng)址:http://zldj.cde.org.cn/home#/home
中企檢測認證網(wǎng)提供iso體系認證機構查詢,檢驗檢測、認證認可、資質(zhì)資格、計量校準、知識產(chǎn)權貫標一站式行業(yè)企業(yè)服務平臺。中企檢測認證網(wǎng)為檢測行業(yè)相關檢驗、檢測、認證、計量、校準機構,儀器設備、耗材、配件、試劑、標準品供應商,法規(guī)咨詢、標準服務、實驗室軟件提供商提供包括品牌宣傳、產(chǎn)品展示、技術交流、新品推薦等全方位推廣服務。這個問題就給大家解答到這里了,如還需要了解更多專業(yè)性問題可以撥打中企檢測認證網(wǎng)在線客服13550333441。為您提供全面檢測、認證、商標、專利、知識產(chǎn)權、版權法律法規(guī)知識資訊,包括商標注冊、食品檢測、第三方檢測機構、網(wǎng)絡信息技術檢測、環(huán)境檢測、管理體系認證、服務體系認證、產(chǎn)品認證、版權登記、專利申請、知識產(chǎn)權、檢測法、認證標準等信息,中企檢測認證網(wǎng)為檢測認證商標專利從業(yè)者提供多種檢測、認證、知識產(chǎn)權、版權、商標、專利的轉(zhuǎn)讓代理查詢法律法規(guī),咨詢輔導等知識。
本文內(nèi)容整合網(wǎng)站:中國政府網(wǎng)、百度百科、最高人民法院、知乎、國家認證認可監(jiān)督管理委員會、國家知識產(chǎn)權局、市場監(jiān)督總局
免責聲明:本文部分內(nèi)容根據(jù)網(wǎng)絡信息整理,文章版權歸原作者所有。向原作者致敬!發(fā)布旨在積善利他,如涉及作品內(nèi)容、版權和其它問題,請跟我們聯(lián)系刪除并致歉!