原標題:國內首仿藥挑戰諾華美國專利!諾華已展開反擊
6月19日,蘇州晶云藥物科技股份有限公司的科創板上市申請正式受理。招股書中,蘇州晶云披露了全資子公司科睿思首仿藥挑戰諾華重磅藥物的最新進展。

6月19日,蘇州晶云藥物科技股份有限公司(簡稱”蘇州晶云“)的科創板上市申請正式受理。
招股書中,蘇州晶云披露了全資子公司科睿思首仿藥挑戰諾華重磅藥物的最新進展。
瑞士諾華公司(Novartis)已經在2019年10月17日在美國特拉華州聯邦初級法院對包括科睿思在內的15位被告提起訴訟,主張在其擁有的專利號為US8,101,659、US8,796,331、US8,877,938及US9,388,134的美國專利(四項專利合稱“原研專利”)到期前,包含科睿思在內的15位被告提交的關于沙庫巴曲纈沙坦鈉片的首仿藥申請,尋求商業生產、使用、銷售、許諾銷售或進口沙庫巴曲纈沙坦鈉片的行為,構成對諾華原研專利的侵權。
諾華原研藥Entresto®沙庫巴曲纈沙坦鈉片是一款抗心衰的重磅藥物,2015年7月7日被美國FDA首次批準上市,是諾華開發的全球首個血管進賬素受體腦啡肽酶抑制劑,2019年全球銷售額17.26億美元。
為什么要挑戰?挑戰成功的首仿藥有180天紅利期
美國1984年9月24日頒布的藥品價格競爭與專利期補償法(又稱Hatch-Waxman法案),開創了仿制藥的現代審評體系,同時對藥品的專利法也做出了重大的更改,從而推動了美國仿制藥快速發展。美國首仿藥的概念也起源于此。
根據美國相關法律規定,持有新藥批件持有人,可以在FDA的橙皮書上列出新藥的相關專利。根據Hatch-Waxman法案,如果仿制藥申請人在橙皮書中參比藥物的專利期沒有屆滿前提出仿制藥上市申請,則需要提交Paragraph IV(Paragraph IV certification)聲明,即主張相關原研專利是無效的,或者其制造、使用或銷售所提交申請的藥品不會侵犯相關原研專利的聲明)。
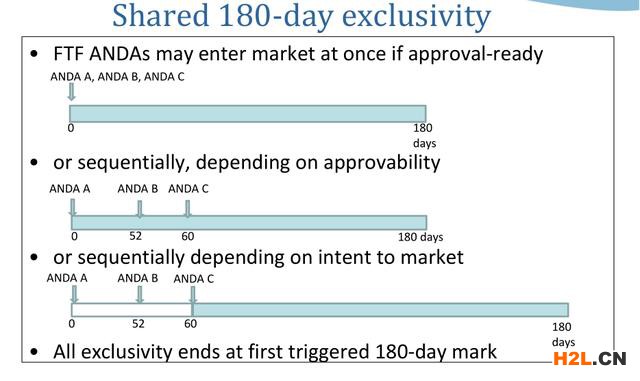
該法案規定,在“專利無效或者批準正在申請的藥物不會侵犯專利”的情況下,第一個向美國FDA遞交ANDA、并含有Paragraph IV聲明的仿制藥申請者,如果專利挑戰成功,則FDA將給予180天的市場獨占期。
為了鼓勵仿制藥企積極挑戰原研藥專利,在這180天內,FDA不再批準其他的ANDA持有人上市,而獲得市場獨占期的仿制藥的定價可以高達原研藥的94%,以彌補其在專利挑戰時消耗的訴訟費用,并快速地收回成本,由于美國的藥品價格完全通過市場競爭決定,政府不進行干預。完全市場化的價格形成機制使得競爭格局成為最重要的價格決定因素,新進入者都將以價格的犧牲來換取市場份額的提升,因此是否獲得180天市場獨占期對收益可以產生非常大的區別。
這個180天的市場獨占期對于仿制藥企業來說非常關鍵。如果不發起專利挑戰,仿制藥企業只能等新藥橙皮書中所列的所有專利都過期之后,方能獲批上市,此時的市場可能已經被原研藥廠和首仿藥廠蠶食殆盡。因此仿制藥企業都很關注在原研藥上市滿4年后的首仿日(NCE-1日)提交挑戰聲明的申請,以期能夠獨享或共享這180天市場獨占期。
科睿思就是在諾華Entresto®上市四年后的首仿日到來那天,于2019年7月8日成功向美國FDA提交了針對原研藥Entresto®的首仿申請,科睿思作為沙庫巴曲纈沙坦鈉片的仿制藥申請人提出了Paragraph IV聲明,主張沙庫巴曲纈沙坦鈉片的相關原研專利是無效的,或者其制造、使用或銷售所提交申請的藥品不會侵犯相關原研專利。
諾華原研藥Entresto®采用了兩種活性成分形成的共晶晶型,并都申請了專利,該共晶專利在中國和美國將分別于2026年和2027年過期,這是科睿思(蘇州晶云)首仿藥開發及專利挑戰的關鍵壁壘。
但據蘇州晶云披露,晶型專利是仿制藥開發的最大壁壘之一,創新晶型技術開發能突破該壁壘,將是盡早將仿制藥成功上市的關鍵。其利用自身技術開發出創新共晶晶型,突破了諾華共晶晶型專利壁壘。
目前該申請正處在審批階段。若該首仿項目成功獲批,則可在諾華Entresto®晶型專利在2026年和2027年過期前提前上市,并與其他獲批該品種首仿藥的企業分享180天的市場獨占期。180天市場獨占期內,僅允許原研藥及首仿藥上市銷售,市場競爭相對較低,首仿藥從而可能獲取較高的市場份額。180天市場獨占期過后可能有其他創新晶型的仿制藥上市,但一般而言,此時首仿藥以其市場先發優勢仍有可能享受較多的市場份額并保持穩定的銷售。
這已不是蘇州晶云第一次參與挑戰美國首仿藥
蘇州晶云是中國首家專注于新藥晶型研發的CRO(Contract Research Organization合同研究組織)公司。CRO企業主要提供從藥物發現、到臨床試驗等各個環節服務的專業機構,承擔某些藥物研制試驗和申報注冊的工作任務,主要服務于新藥上市及之前的階段。
截至2019年12月31日,蘇州晶云擁有34項已授權的國內專利(其中發明專利30項)和80項已授權的境外專利。
據其招股書披露,在挑戰諾華之前,蘇州晶云就曾參與過對強生等公司研發的Imbruvica®依布替尼膠囊的美國首仿申請。
Imbruvica®依布替尼膠囊是由強生公司和Pharmacyclics,Inc.(2015年5月被艾伯維收購)聯合開發的全球首個上市的BTK抑制劑,用于套細胞淋巴瘤、慢性淋巴細胞白血病小淋巴細胞淋巴瘤患者的治療。
該原研藥于2013年11月在美國獲批上市,2017年8月在中國獲批上市。該原研藥化合物和晶型的美國專利分別將在2027年11月和2033年10月過期,相差近6年時間。
蘇州晶云針對該原研藥的創新晶型專利(US9751889)于2017年9月獲得美國專利局授權,這意味著相較于普通仿制藥,采用該創新晶型技術的合作伙伴可將其開發的仿制藥提前6年推向市場。
2015年,公司將該創新晶型專利及技術許可給西班牙知名原料藥公司Esteve Quimica, S.A.,以支持其開發對應的創新晶型原料藥。利用Esteve Quimica, S.A.供應的創新晶型原料藥,兩家國際仿制藥公司開發出針對Imbruvica®的首仿藥,于2017年11月13日成功向美國FDA提交首仿申請。
諾華對科睿思(蘇州晶云)專利挑戰的反擊和影響
FDA在受理了科睿思的首仿藥上市申請后,科睿思已根據相關法律規定向諾華發出了書面通知,載明其已申請沙庫巴曲纈沙坦鈉片首仿藥上市的事實和法律依據等。
諾華在收到科睿思的通知之日起45日內提起了訴訟。諾華的訴訟請求具體包括:
(1)判決科睿思提交首仿藥申請侵犯了其原研專利;
(2)頒發永久禁令,禁止科睿思及其高管、代理、律師、雇員等人員在原研專利到期(含專利延長期)前于美國境內參與商業制造、使用、銷售、許諾銷售,或向美國進口科睿思首仿藥申請項下的產品;
(3)裁定原研專利到期前(含專利延長期),科睿思的首仿藥申請不得審批通過;
(4)判決參與商業制造、使用、銷售、許諾銷售或進口科睿思首仿藥申請項下產品構成對原研專利的直接侵權、間接侵權或幫助侵權;
(5)科睿思應當對原研專利的直接侵權、間接侵權或幫助侵權承擔賠償責任;
(6)判決由科睿思承擔諾華的律師費;
(7)判決由科睿思承擔諾華因本訴訟產生的支出和費用;
(8)其他法院認為公正恰當的救濟。
2020年1月7日,科睿思提交了答辯狀。
根據美國的相關法律規定,如新藥批件持有人和專利所有權人在收到通知的45日內提起訴訟,FDA的審批將自動中止,除非特定情形發生(如法院判決不存在侵權行為或原研專利無效),否則FDA在30個月內不得批準首仿藥申請。
鑒于這30個月的時間對于新藥批件持有人和專利所有權人的價值,新藥批件持有人和專利所有權人幾乎都會在45日的期限內提起訴訟。
因此,該類訴訟屬于新藥批件持有人和專利所有權人為了延緩首仿藥申請的獲批而進行的戰略性訴訟。
目前該專利訴訟處于早期階段,尚未進入證據調查階段。根據代理科睿思的美國律師事務所Parker Poe出具的法律意見,Parker Poe認為如果法院獲得全部的相關信息,法院應會作出支持科睿思的判決。如果科睿思被判決敗訴,諾華最可能采取的救濟手段是禁止科睿思的產品在原研專利到期前獲批上市。
值得注意的是,此次科睿思(蘇州晶云)對諾華首仿藥挑戰,還聯合了其它機構一起分擔訴訟風險。
科睿思與Harman Finochem Limited、Sparta SPV,LLC在2019年12月26日簽訂《開發、許可和商業化協議》:約定科睿思、Harman Finochem Limited共同將其沙庫巴曲纈沙坦鈉片項目的47.5%收益轉讓予Sparta SPV,LLC,SpartaSPV,LLC向科睿思及Harman Finochem Limited支付相應對價。
科睿思就前述諾華訴訟發生的訴訟費用(不超過350萬美元)和上訴費用(不超過40萬美元),將由Sparta SPV,LLC先行承擔。
未來沙庫巴曲纈沙坦鈉片上市銷售的收益,優先分配給Sparta,以補償其實際承擔的訴訟費用、上訴費用和為本次交易發生的費用(不超過410萬美元),然后再按比例向科睿思、Harman Finochem Limited和Sparta SPV,LLC三方分配。
中企檢測認證網提供iso體系認證機構查詢,檢驗檢測、認證認可、資質資格、計量校準、知識產權貫標一站式行業企業服務平臺。中企檢測認證網為檢測行業相關檢驗、檢測、認證、計量、校準機構,儀器設備、耗材、配件、試劑、標準品供應商,法規咨詢、標準服務、實驗室軟件提供商提供包括品牌宣傳、產品展示、技術交流、新品推薦等全方位推廣服務。這個問題就給大家解答到這里了,如還需要了解更多專業性問題可以撥打中企檢測認證網在線客服13550333441。為您提供全面檢測、認證、商標、專利、知識產權、版權法律法規知識資訊,包括商標注冊、食品檢測、第三方檢測機構、網絡信息技術檢測、環境檢測、管理體系認證、服務體系認證、產品認證、版權登記、專利申請、知識產權、檢測法、認證標準等信息,中企檢測認證網為檢測認證商標專利從業者提供多種檢測、認證、知識產權、版權、商標、專利的轉讓代理查詢法律法規,咨詢輔導等知識。
本文內容整合網站:中國政府網、百度百科、搜狗百科、360百科、最高人民法院、知乎、市場監督總局 、國家知識產權局、國家商標局
免責聲明:本文部分內容根據網絡信息整理,文章版權歸原作者所有。向原作者致敬!發布旨在積善利他,如涉及作品內容、版權和其它問題,請跟我們聯系刪除并致歉!






